HyQvia
Information destinée aux patients en Suisse
Qu’est-ce que HyQvia et quand doit-il être utilisé ?
HyQvia est composé de deux solutions pour perfusion (goutte-à-goutte) sous la peau (par voie sous-cutanée [s.c.]). Il est fourni dans une boîte contenant un flacon d’immunoglobuline humaine normale à 10 % (le principe actif) et un flacon de hyaluronidase humaine recombinante (une substance qui aide l’immunoglobuline humaine normale à 10 % à atteindre votre sang).
Les immunoglobulines sont des anticorps et sont présentes dans le sang des personnes saines. Les anticorps font partie du système immunitaire (défenses naturelles du corps) et aident votre organisme à combattre les infections.
Le flacon d’immunoglobuline a été préparé à partir du sang de donneurs saine. Ce médicament agit exactement de la même manière que les immunoglobulines naturellement présentes dans le sang. La hyaluronidase humaine recombinante est une protéine qui facilite la perfusion (administration goutte-à-goutte) des immunoglobulines sous la peau et leur diffusion dans la circulation sanguine.
HyQvia est utilisé sur prescription médicale.
HyQvia est utilisé chez les patients adults présentant un système immunitaire affaibli, qui ne possèdent pas suffisamment d’anticorps dans le sang et qui souffrent d’infections fréquentes. Des doses régulières et suffisantes d’HyQvia peuvent augmenter les taux sanguins d’immunoglobuline anormalement bas afin de leur permettre d’atteindre un niveau normal (traitement substitutif).
HyQvia est prescrit comme traitement substitutif chez des patients adults qui ne possèdent pas suffisamment d’anticorps, y compris dans les groupes suivants:
– patients dont la capacité innée à produire des anticorps est réduite ou inexistante (immunodéficiences primaires).
– patients atteints d’infections sévères ou récurrentes dues à un système immunitaire affaibli en raison d’autres pathologies ou traitements.
Quand HyQvia ne doit-il pas être utilisé ?
HyQvia ne doit PAS être injecté ou perfusé
– si vous êtes allergique aux immunoglobulines humaines, à la hyaluronidase, à la hyaluronidase recombinante ou à l’un des autres composants contenus dans ce médicament selon la composition.
– si vous avez des anticorps contre l’immunoglobuline de type A (IgA) dans le sang. Cela peut se produire si vous souffrez d’un déficit en IgA. Etant donné que HyQvia contient des traces d’IgA, vous pouvez présenter une réaction allergique.
– HyQvia ne doit PAS être administré dans un vaisseau sanguin (voie intraveineuse) ou dans un muscle (voie intramusculaire).
Quelles sont les précautions à observer lors de l’utilisation de HyQvia ?
Les mises en garde et précautions suivantes doivent être prises en compte avant de recevoir ou d’utiliser HyQvia. Si vous avez des questions, adressez-vous à votre médecin ou au professionnel de la santé.
Réactions allergiques
Vous pouvez être allergique aux immunoglobulines sans le savoir. Des réactions allergiques telles qu’une chute soudaine de la pression artérielle ou un choc anaphylactique (chute brutale de la pression artérielle accompagnée d’autres symptômes tels que le gonflement de la gorge, des difficultés à respirer et un rash cutané) sont rares mais peuvent occasionnellement survenir, même si vous n’avez encore jamais eu de problèmes avec des traitements similaires reçus précédemment. Vous présentez un risque accru de réactions allergiques si vous souffrez de déficit en IgA avec présence d’anticorps anti-IgA. Les signes ou symptômes de ces réactions allergiques rares englobent:
– des sensations d’étourdissement, de vertiges ou un évanouissement,
– un rash cutané, une urticaire, des démangeaisons (prurit), un gonflement de la bouche ou de la gorge,
– des difficultés à respirer, une respiration haletante ou sifflante (ronchi),
– une fréquence cardiaque anormale, une douleur dans la poitrine, une coloration bleue des lèvres ou des doigts et des orteils,
– des troubles de la vision.
Votre médecin ou un professionnel de la santé vous perfusera d’abord HyQvia lentement et vous surveillera attentivement au cours des premières perfusions afin de détecter et de traiter immédiatement toute réaction allergique éventuelle.
Si vous constatez l’apparition de l’un de ces signes pendant la perfusion, informez immédiatement votre médecin ou un professionnel de la santé, qui décidera alors s’il convient de ralentir la vitesse de la perfusion ou de l’interrompre totalement.
Vitesse de perfusion
Il est très important de perfuser le médicament à la vitesse correcte. Votre médecin ou un professionnel de la santé vous indiquera la vitesse adéquate à utiliser lors de la perfusion d’HyQvia à domicile (voir rubrique «Comment utiliser HyQvia ?»).
Surveillance pendant la perfusion
Certains effets secondaires risquent d’apparaître plus fréquemment si:
– vous recevez HyQvia pour la première fois,
– vous avez reçu une autre immunoglobuline auparavant et vous venez de passer à HyQvia,
– le traitement a été interrompu pendant une longue période (par ex., plus de 2 ou 3 intervalles de perfusion) depuis la dernière perfusion d’HyQvia.
Dans ces circonstances, vous serez surveillé attentivement pendant la première perfusion et l’heure suivant la fin de l’administration.
Dans tous les autres cas, vous devrez être surveillé pendant la perfusion et pendant au moins les 20 minutes suivant la fin de l’administration au cours des premières perfusions d’HyQvia.
Traitement à domicile
Avant de commencer un traitement à domicile, vous devez désigner une personne comme accompagnant, qui sera formée (tout comme vous) à détecter les premiers signes d’effets secondaires, en particulier de réactions allergiques. Cet accompagnant vous aidera à surveiller la survenue d’effets secondaires potentiels. Pendant la perfusion, vous devez être attentif aux premiers signes d’effets secondaires (pour plus de détails, voir rubrique «Quels effets secondaires HyQvia peut-il provoquer ?»).
Le cas échéant, vous (ou votre accompagnant) devez interrompre immédiatement la perfusion et appeler un médecin.
En présence d’un effet secondaire grave, vous (ou votre accompagnant) devez demander immédiatement un traitement d’urgence.
Formation de caillots (thrombose)
Une thrombose est la formation d’un caillot pouvant boucher un vaisseau sanguin. La formation de caillots dans le cœur, le cerveau, une veine ou dans les poumons a été associée à l’utilisation d’HyQvia.
Veuillez informer votre médecin si vous souffrez ou avez souffert d’hypertension ou de diabète, si vous souffrez de maladies vasculaires ou sanguines, y compris la formation de caillots, et si vous êtes immobilisé pendant une plus longue période.
En cas d’apparition d’un des symptômes suivants, vous devez immédiatement arrêter l’utilisation d’HyQvia et prévenir directement votre médecin ou le professionnel de la santé: difficultés respiratoires, douleur et gonflements des bras ou des jambes, troubles du langage, troubles de la vision, troubles de la motricité ou troubles sensoriels et douleurs dans la poitrine.
Vous devez veiller à boire suffisamment de liquide avant d’utiliser HyQvia.
Inflammation des membranes couvrant le cerveau et la moelle épinière (syndrome de méningite aseptique)
Des syndromes de méningite aseptique sont apparus sous HyQvia. Contactez immédiatement votre médecin si vous souffrez de maux de tête intenses, d’une raideur de la nuque, de somnolence, de fièvre, de sensibilité à lumière, de nausées ou de vomissements. Ces symptômes peuvent apparaître plusieurs heures à deux jours après l’utilisation d’HyQvia.
Propagation d’infections localisées
Ne perfusez pas HyQvia dans ou autour d’une zone infectée ou gonflée et rouge, car cela pourrait entraîner la propagation de l’infection.
Modifications de la peau
Aucune modification à long terme (chronique) de la peau n’a été observée lors des études cliniques. Tout cas d’inflammation chronique, d’excroissance (nodule) ou d’inflammation apparaissant sur le site de perfusion et persistant plus de quelques jours doit être signalé à votre médecin.
Influence sur les tests sanguins
HyQvia contient de nombreux anticorps différents, dont certains peuvent altérer les résultats des tests sanguins (tests sérologiques).
Veuillez informer votre médecin de votre traitement par HyQvia avant tout test sanguin.
Informations sur la composition d’HyQvia
L’immunoglobuline humaine normale d’HyQvia et l’albumine sérique humaine (un composant de la hyaluronidase humaine recombinante) sont extraites du plasma humain (la partie liquide du sang). Lorsque des médicaments sont préparés à partir de sang ou de plasma humain, des mesures de prévention de la transmission d’agents infectieux aux patients sont mises en place. Ces mesures comprennent:
– la sélection soigneuse des donneurs de sang et de plasma de façon à exclure les donneurs risquant d’être porteurs d’infections et
– le contrôle de chaque don individuel et pool de plasma afin de détecter tout signe de virus/d’infection.
La fabrication de produits à base de sang et de plasma met également en œuvre dans son processus des étapes d’inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission de maladies infectieuses ne peut pas être totalement exclu. Ceci s’applique également aux virus inconnus ou émergents, ainsi qu’aux autres types d’agents infectieux.
Les mesures prises lors de la fabrication d’HyQvia sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite B, le virus de l’hépatite C, ainsi que du virus non enveloppé de l’hépatite A et du parvovirus B19.
Les immunoglobulines ne sont pas associées aux infections par le virus de l’hépatite A et le parvovirus B19, probablement grâce aux anticorps protecteurs présents dans ce produit.
Il est fortement recommandé de consigner les informations suivantes dans votre carnet de traitement à chaque utilisation d’HyQvia:
– la date d’administration,
– le numéro de lot du médicament,
– le volume injecté, le débit de perfusion ainsi que les sites de perfusion et leur nombre.
Utilisation d’HyQvia avec d’autres médicaments
Vaccinations
HyQvia peut réduire l’effet de certains vaccins à virus vivants atténués tels que les vaccins contre la rougeole, la rubéole, les oreillons et la varicelle. Par conséquent, après l’administration d’HyQvia, vous devez respecter un intervalle de 3 mois avant de pouvoir recevoir certains vaccins. Dans le cas du vaccin contre la rougeole, cette période d’attente peut atteindre 1 an après l’administration d’HyQvia.
Informez le médecin ou le professionnel de la santé administrant votre vaccin de votre traitement par HyQvia.
Aptitude à conduire et capacité à utiliser des machines
Pendant le traitement avec HyQvia, les patients peuvent présenter des effets indésirables (par exemple, vertiges ou nausées) susceptibles d’affecter la capacité à conduire des véhicules et à utiliser des machines. Dans ce cas, vous ne devez pas conduire de véhicule ni utiliser de machine jusqu’à disparition de ces effets secondaires.
Excipients
Ce médicament contient entre 5,0 et 60,5 mg de sodium (composant principal du sel de cuisine/de table) dans chaque flacon de hyaluronidase humaine recombinante de HyQvia. Cela correspond à une quantité comprise entre 0,25 et 3 % de l’apport alimentaire quotidien maximal en sodium recommandé pour un adulte. Le composant immunoglobuline contient moins de 1 mmol de sodium (23 mg) par flacon et est, par conséquent, essentiellement sans sodium.
Veuillez informer votre médecin ou votre pharmacien si
– vous souffrez d’une autre maladie,
– vous êtes allergique ou
– vous prenez déjà d’autres médicaments (ou utilisez déjà d’autres médicaments en usage externe) (même en automédication!).
HyQvia peut-il être utilisé pendant la grossesse ou l’allaitement ?
Les données concernant les effets de l’utilisation à long terme de la hyaluronidase humaine recombinante sur la grossesse, l’allaitement et la fertilité sont limitées. HyQvia doit être utilisé par la femme enceinte ou allaitante uniquement après avoir consulté un médecin et après une évaluation médicale minutieuse du rapport bénéfice-risque.
Comment utiliser HyQvia ?
Veuillez toujours utiliser HyQvia en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
Le traitement par HyQvia sera démarré par votre médecin ou professionnel de la santé , mais vous serez peut-être autorisé à utiliser le médicament à domicile après avoir reçu les premières perfusions sous surveillance médicale et après avoir suivi (vous et/ou votre accompagnant) une formation adéquate. Vous déciderez, en accord avec votre médecin, si vous pouvez utiliser HyQvia à domicile. Ne commencez pas le traitement par HyQvia à domicile avant d’avoir reçu les instructions complètes.
Posologie
Votre médecin calculera la dose correcte pour vous en fonction de votre poids corporel, de vos éventuels traitements antérieurs et de votre réponse au traitement. La dose de départ recommandée est de 400 à 800 mg de principe actif par kg de poids corporel par mois. Au début, vous recevrez un quart de cette dose à intervalles d’une semaine. Elle sera progressivement augmentée à intervalles de 3 à 4 semaines au cours des perfusions suivantes. Il peut arriver que votre médecin recommande de fractionner les doses plus importantes pour la perfusion et de les administrer simultanément en deux sites. Votre médecin peut également ajuster votre dose en fonction de votre réponse au traitement.
Début du traitement
Votre traitement sera démarré par un médecin ou un professionnel de la santé expérimenté dans le traitement des patients présentant un système immunitaire affaibli et dans l’encadrement des patients traités à domicile. Vous serez suivi attentivement pendant toute la perfusion et pendant au moins une heure après la fin de la perfusion afin d’évaluer votre tolérance au médicament. Au début, le médecin ou le professionnel de la santé utilisera une vitesse de perfusion lente, puis l’augmentera progressivement pendant la première perfusion et les suivantes. Une fois que le médecin ou le professionnel de la santé aura défini la dose et la vitesse de perfusion qui vous conviennent, vous pourrez vous administrer le traitement vous-même, à domicile.
Traitement à domicile
Vous serez formé sur les aspects suivants:
– les techniques de perfusion stériles (aseptiques),
– l’utilisation d’une pompe à perfusion ou d’un pousse-seringue,
– la tenue d’un carnet de traitement,
– les mesures à prendre en cas d’effets secondaires graves.
Recommandations relatives à l’utilisation
Vous devez respecter scrupuleusement les instructions de votre médecin concernant la dose, la vitesse de perfusion et le calendrier de perfusion d’HyQvia afin d’assurer l’efficacité maximale du traitement.
HyQvia doit être perfusé sous la peau (par voie sous-cutanée).
HyQvia contient deux flacons qui doivent être administrés l’un après l’autre au site de perfusion choisi. Ne mélangez pas le contenu des deux flacons avant l’utilisation.
Vous trouverez des instructions détaillées sur l’administration de la perfusion à la fin de ce chapitre, dans la rubrique «Instructions pour l’administration d’HyQvia».
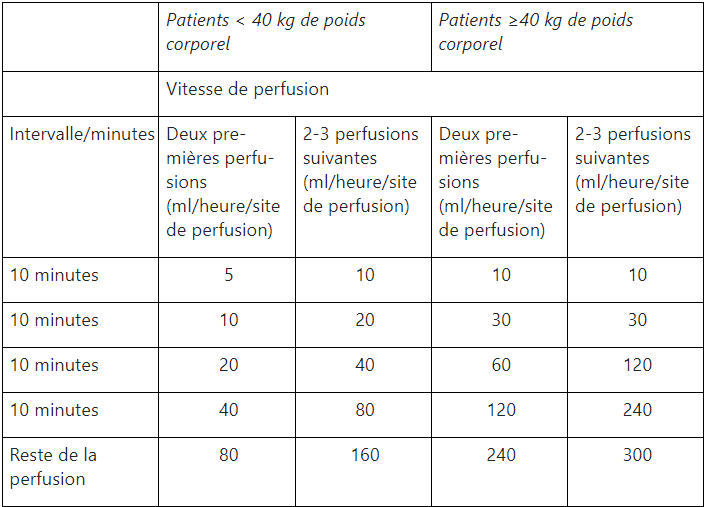
Vitesse de perfusion pour l’administration de l’immunoglobuline:
Pour l’administration du flacon contenant le principe actif, il est recommandé d’augmenter progressivement la vitesse de perfusion selon les indications du tableau:
Si une fuite au site de perfusion se produit
Demandez à votre médecin si vous constatez au site de perfusion une fuite de la solution pour perfusion HyQvia pendant l’administration. Une autre taille d’aiguille vous conviendrait éventuellement mieux. Tout changement de taille d’aiguille doit être supervisé par le médecin traitant.
Si vous avez utilisé plus d’HyQvia que vous n’auriez dû
Si vous pensez avoir utilisé plus d’HyQvia que vous n’auriez dû, adressez-vous à votre médecin dès que possible.
Si vous avez oublié d’utiliser HyQvia
Ne perfusez pas de dose double d’HyQvia pour compenser la dose que vous avez oublié de prendre. Si vous pensez avoir oublié une dose, contactez votre médecin dès que possible.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin, à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, votre pharmacien ou au professionnel de la santé.
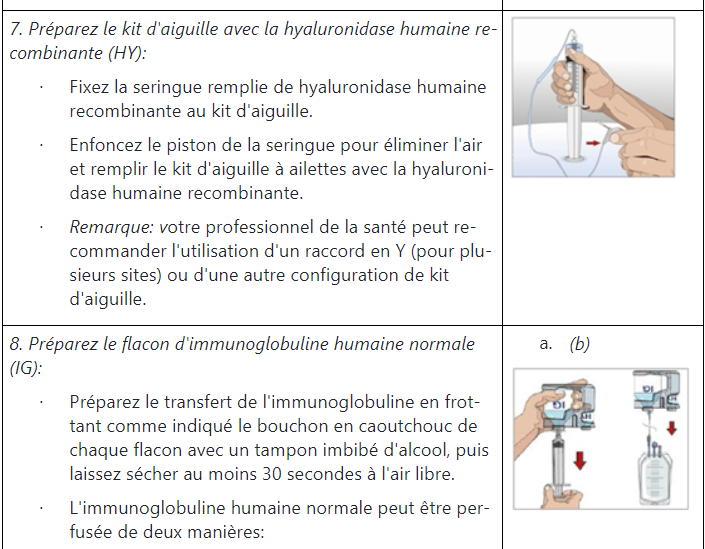
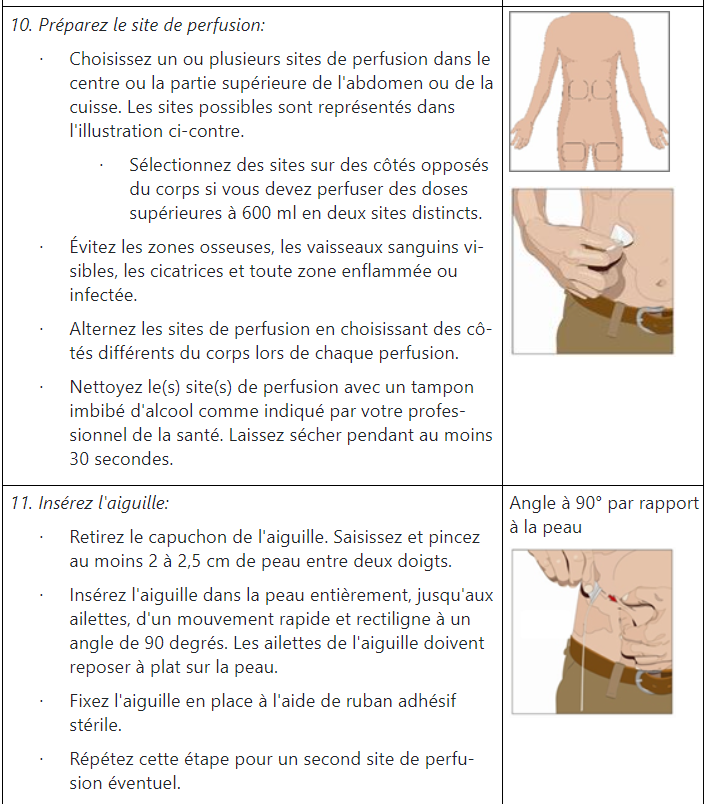
Instructions pour l’administration d’HyQvia







Quels effets secondaires HyQvia peut-il provoquer ?
Comme tous les médicaments, ce médicament peut provoquer des effets secondaires, mais ils ne surviennent pas systématiquement chez tout le monde. Certains effets secondaires, tels que céphalée, frissons ou douleurs articulaires, peuvent être réduits en ralentissant la vitesse de perfusion.
Effets secondaires graves
Les perfusions de médicaments tels que HyQvia peuvent occasionnellement entraîner des réactions allergiques graves mais rares. Vous pouvez ressentir une chute de tension soudaine et, dans des cas isolés, un choc anaphylactique. Les médecins sont informés du risque d’apparition de ces effets secondaires et vous surveilleront pendant et après les premières perfusions.
Les signes ou symptômes typiques comprennent: des sensations d’étourdissement, de vertiges ou un évanouissement, un rash cutané et des démangeaisons, un gonflement dans la bouche ou la gorge, des difficultés à respirer, une respiration haletante ou sifflante, une fréquence cardiaque anormale, une douleur dans la poitrine, une coloration bleue des lèvres ou des doigts et des orteils, une vision floue.
– Informez immédiatement votre médecin ou infirmier/infirmière si vous constatez l’apparition de l’un de ces signes pendant la perfusion.
– En cas d’utilisation d’HyQvia à domicile, vous devez effectuer la perfusion en présence d’un accompagnant désigné, qui vous aidera à détecter l’apparition de réactions allergiques, à arrêter la perfusion et à chercher de l’aide au besoin.
Voir aussi rubrique «Quelles sont les précautions à observer lors de l’utilisation de HyQvia ?» sur le risque de réactions allergiques et l’utilisation d’HyQvia à domicile dans cette notice d’emballage.
Effets secondaires très fréquents (pouvant survenir pendant plus de 1 perfusion sur 10):
douleur au site de perfusion, dont gêne légère à modérée et sensibilité au toucher, douleur à la pression, douleur dans l’aine. Ces réactions disparaissent généralement en quelques jours.
Effets secondaires fréquents (pouvant survenir pendant jusqu’à 1 perfusion sur 10):
Réactions au site de perfusion: rougeur, gonflement, démangeaisons, durcissement de la peau et rash au site de perfusion. Ces réactions disparaissent généralement en quelques jours. Céphalées, fatigue, nausées, vomissements, diarrhée, douleurs abdominales, douleurs musculaires, douleurs thoraciques, fièvre, sensation de faiblesse, apathie ou sensation générale de malaise, accélération de la fréquence cardiaque, rougissement ou pâlissement de la peau, essoufflement, rigidité musculaire, gonflement des ganglions lymphatiques, appétit réduit, crises d’angoisse, insomnie, picotements de la peau, engourdissement de la peau, conjonctivite, rhinorrhée, congestion nasale, douleurs dans l’oropharynx, troubles digestifs, contusion, dermatite, crampes musculaires, faiblesse musculaire, gêne thoracique.
Effets secondaires occasionnels (pouvant survenir pendant jusqu’à 1 perfusion sur 100):
Réactions au site d’injection: coloration, ecchymoses (y compris hématome, saignement), formation de nodules, chaleur ou durcissements, frissons, migraine, élévation de la tension, vertiges, flatulences, éruption cutanée/éruption allergique/rougeur, démangeaisons, urticaire, douleurs dans la poitrine, les bras et/ou les jambes, douleurs dorsales, douleurs articulaires, gonflement dans la région génitale (résultant d’une propagation du gonflement depuis le site de perfusion), gonflement des jambes, des pieds et dans la région des chevilles, transpiration excessive, tests sanguins positifs sur anticorps, hypersensibilité, réaction anaphylactique, irritabilité, tremblements, mains ou pieds froids, gonflement du visage, modification des valeurs hépatiques dans le sang (élévation de l’alanine-aminotransférase), baisse du nombre de globules blancs, baisse de l’hématocrite, baisse du nombre de globules rouges, maladie de la thyroïde, trouble de la mémoire, trouble du langage, trouble du goût, troubles de l’équilibre, douleur oculaire, gonflement des yeux, accumulation de liquide dans l’oreille moyenne, inflammation d’une veine, gonflement de la bouche ou de la gorge, augmentation du rythme respiratoire, ballonnement, augmentation du cholestérol sanguin, gonflement de la peau, sueurs froides, sensibilité à la lumière, sueurs nocturnes, contractions musculaires, excrétion excessive de protéines dans les urines, élévation du taux de créatinine dans le sang, élévation du taux d’urée dans le sang, oppression de la poitrine, bouffées de chaleur, sensation de froid dans les bras ou les jambes.
Effets secondaires rares (pouvant survenir pendant jusqu’à 1 perfusion sur 1000):
Picotements de la peau, sensation de brûlure, caillot de sang dans les vaisseaux, picotements dans la cavité buccale, dissolution des globules rouges (hémolyse), urine brune.
Fréquence inconnue (ne peut être estimée sur la base des données disponibles):
Hypersensibilité, réactions allergiques, choc anaphylactique, réaction anaphylactique, syndrome grippal, fuite de la solution au site de perfusion, inflammation des membranes entourant le cerveau et la moelle épinière (méningite aseptique), caillot de sang dans les vaisseaux (réactions thromboemboliques) pouvant mener à un infarctus du myocarde, une attaque cérébrale, l’occlusion de veines profondes ou d’un vaisseau sanguin dans les poumons (embolie pulmonaire), troubles de la fonction rénale ou insuffisance rénale, baisse de l’oxygénation, hypotension, trouble circulatoire du cerveau, attaque cérébrale, infarctus du myocarde, œdème pulmonaire, maladie pulmonaire aiguë qui survient après une transfusion de produits sanguins, collapsus circulatoire, toux, sensation d’étouffement, asthme, difficultés respiratoires, rougissement de la peau, éruption cutanée généralisée, éruption cutanée desquamative, desquamation de la peau, éruption cutanée abdominale.
Les effets secondaires indiqués en italiques ont été observés lors de la perfusion de médicaments similaires à l’immunoglobuline humaine normale et administrés sous la peau (voie sous-cutanée) ou dans une veine (voie intraveineuse) ou ont été observée lorsqu’une préparation analogue à HyQvia est administrée dans une veine. Bien que ces effets secondaires n’aient pas encore été observés sous HyQvia, il se peut qu’ils apparaissent aussi sous HyQvia.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin, votre pharmacien ou votre professionnel de la santé. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d’emballage.
À quoi faut-il encore faire attention ?
Conserver hors de la portée des enfants.
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Conserver au réfrigérateur (2 °C – 8 °C). Ne pas congeler. Ne pas secouer.
Conserver les flacons dans leur carton pour les protéger de la lumière.
Ne pas utiliser ce médicament si les solutions sont décolorées ou troubles ou contiennent des particules ou des dépôts. Ne pas mélanger les deux solutions pour perfusion. Ne pas mélanger HyQvia avec d’autres médicaments.
Après ouverture, jeter les solutions inutilisées.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien comment éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d’une information détaillée destinée aux professionnels.
Que contient HyQvia ?
HyQvia comprend 2 composants:
– une solution pour perfusion de hyaluronidase humaine recombinante et
– une solution pour perfusion d’immunoglobuline humaine normale.
1. Flacon de hyaluronidase humaine recombinante
Excipients
Hyaluronidase humaine recombinante, chlorure de sodium, phosphate de sodium, hydroxyde de sodium, albumine humaine, acide éthylène-diamine-tétracétique (EDTA) disodique, chlorure de calcium, acide chlorhydrique et eau pour préparations injectables (teneur en sodium: voir aussi «Quelles sont les précautions à observer lors de l’utilisation d’HyQvia ?»).
2. Flacon d’immunoglobuline humaine normale 100 mg/ml
Principes actifs
Immunoglobuline humaine normale
Un millilitre de la solution pour perfusion contient 100 mg d’immunoglobuline humaine normale dont au moins 98 % d’immunoglobuline G (IgG).
Excipients
Glycine, eau pour préparations injectables.
Ce médicament contient des traces d’immunoglobuline A (IgA) (140 microgrammes/ml au maximum, 37 microgrammes en moyenne).
Numéro d’autorisation
66’684 (Swissmedic)
Où obtenez-vous HyQvia ? Quels sont les emballages à disposition sur le marché ?
En pharmacie, seulement sur ordonnance médicale.
Un emballage d’HyQvia 2,5 g/25 ml contient un flacon d’immunoglobuline humaine normale de 25 ml et un flacon d’hyaluronidase humaine recombinante de 1,25 ml.
Un emballage d’HyQvia 5 g/50 ml contient un flacon d’immunoglobuline humaine normale de 50 ml et un flacon d’hyaluronidase humaine recombinante de 2,5 ml.
Un emballage d’HyQvia 10 g/100 ml contient un flacon d’immunoglobuline humaine normale de 100 ml et un flacon d’hyaluronidase humaine recombinante de 5 ml.
Un emballage d’HyQvia 20 g/200 ml contient un flacon d’immunoglobuline humaine normale de 200 ml et un flacon d’hyaluronidase humaine recombinante de 10 ml.
Un emballage d’HyQvia 30 g/300 ml contient un flacon d’immunoglobuline humaine normale de 300 ml et un flacon d’hyaluronidase humaine recombinante de 15 ml.
Titulaire de l’autorisation
Takeda Pharma AG, 8152 Opfikon
Cette notice d’emballage a été vérifiée pour la dernière fois en décembre 2023 par l’autorité de contrôle des médicaments (Swissmedic).
Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 05.02.2024, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans le paragraphe en gras juste ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 3ème mise à jour de cette page depuis le lancement début 2021 de cette rubrique. Mise à jour 1 (août 2022). Mise à jour 2 (octobre 2023).
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


