Luveris® 75 UI
Information destinée aux patients en Suisse
Qu’est-ce que Luveris et quand doit-il être utilisé ?
Luveris contient comme principe actif de la lutropine alfa, une hormone lutéinisante recombinante (r-hLH) essentiellement identique à l’hormone naturelle présente chez l’être humain, mais produite par biotechnologie (génie génétique). Elle appartient au groupe des hormones appelées gonadotrophines, qui contrôlent entre autres les fonctions des glandes sexuelles féminines (ovaires) et participent ainsi au contrôle normal de la reproduction.
Ce médicament ne doit être utilisé que sur prescription médicale.
Luveris est employé chez la femme lors des indications suivantes:
– pour le traitement des femmes présentant un déficit en LH. Luveris est administré avec une autre hormone appelée FSH (hormone folliculo-stimulante) pour provoquer la croissance et le développement d’ovules (follicules). Les follicules sont des structures présentes dans les ovaires dans lesquelles les ovules subissent leur maturation. Après le traitement par Luveris et FSH, une dose unique de choriogonadotropine humaine (hCG) est administrée, ce qui entraîne la libération d’un ovule en dehors du follicule (ovulation).
De quoi faut-il tenir compte en dehors du traitement ?
Les causes de votre infertilité ou de celle de votre partenaire doivent être précisément établies avant le début du traitement.
Quand Luveris ne doit-il pas être pris/utilisé ?
Vous ne devez pas prendre Luveris si la réponse à l’une des questions suivantes est «OUI»:
– Êtes-vous allergique à ce médicament, à des médicaments similaires ou à l’un des autres composants du médicament ?
– Vous a-t-on diagnostiqué un cancer de l’ovaire, de l’utérus ou du sein ?
– Vous a-t-on diagnostiqué une tumeur au cerveau ?
– Souffrez-vous d’une hypertrophie ovarienne ou de kystes ovariens d’origine inconnue (à l’exception d’altérations polykystiques bénignes des ovaires) ?
– Avez-vous des saignements vaginaux inexpliqués ?
– Êtes-vous enceinte ou allaitez-vous ?
Quelles sont les précautions à observer lors de la prise/de l’utilisation de Luveris ?
Avant de commencer le traitement, il faut établir les causes exactes de l’infertilité du couple et exclure les raisons rendant une grossesse impossible, telles que des malformations des organes sexuels ou des tumeurs bénignes de l’utérus.
Syndrome d’hyperstimulation ovarienne (SHO)
Bien que le respect strict du dosage recommandé et des examens de contrôle prescrits réduise le risque d’effets secondaires, le risque de syndrome d’hyperstimulation ovarienne doit être pris en considération. Ce syndrome est caractérisé par une hypertrophie excessive des ovaires et des symptômes tels que des douleurs au bas-ventre, éventuellement associées à des nausées, vomissements, malaises, troubles respiratoires ou une prise de poids rapide (voir Quels effets secondaires Luveris peut-il provoquer ?).
Des complications telles qu’une torsion des ovaires et des saignements dans la région abdominale ont été très rarement observées.
Si les symptômes décrits se manifestent chez vous, contactez immédiatement votre médecin.
Dans les cas où le développement d’un SHO s’annonce, il est conseillé de ne pas administrer l’hCG et d’éviter les rapports sexuels pendant au moins 4 jours ou d’utiliser des moyens contraceptifs appropriés (méthodes de barrière).
Le syndrome d’hyperstimulation ovarienne se manifeste cependant en général 1 à 2 semaines après l’injection d’hCG. Son degré de gravité peut varier considérablement.
Chez les femmes subissant un traitement destiné à induire une maturation multifolliculaire, le risque de syndrome d’hyperstimulation ovarienne est plus grand, mais peut toutefois être réduit par l’aspiration de tous les follicules avant l’ovulation.
Grossesses multiples
Le risque de grossesses multiples après application de techniques de procréation médicalement assistée est lié à votre âge ainsi qu’au nombre d’ovules/embryons transférés. Chez les patientes subissant un traitement destiné à déclencher l’ovulation, la fréquence d’une grossesse multiple ou plus exactement d’une naissance multiple est accrue par rapport à la conception naturelle. Toutefois, le risque de tels événements peut être diminué en appliquant le dosage et le schéma thérapeutique recommandés.
Grossesse ectopique
Une grossesse ectopique peut survenir en particulier chez les femmes ayant des antécédents de pathologie tubaire; ceci signifie que l’embryon s’implante en dehors de l’utérus.
Fausses-couches
Lors de l’utilisation de techniques de procréation médicalement assistée ou de stimulation ovarienne, une fausse-couche est plus probable que dans la population féminine en général.
Malformations
La fréquence des malformations peut être un peu plus élevée après utilisation de techniques de procréation médicalement assistée (PMA) qu’après une conception naturelle. Ceci peut être lié à des facteurs de risque parentaux comme l’âge de la mère, les prédispositions génétiques, l’utilisation de techniques de PMA et les grossesses multiples.
Troubles de la coagulation sanguine (accidents thromboemboliques)
Si vous présentez des facteurs de risque connus d’apparition de caillots sanguins dans les gros vaisseaux sanguins (accidents thromboemboliques), tels que surpoids, tabagisme, antécédents personnels ou familiaux, ce risque peut encore s’accroître pendant le traitement par Luveris. Il faut toutefois noter qu’une grossesse en soi augmente également ce risque (voir Quels effets secondaires Luveris peut-il provoquer ?).
Tumeurs
Des tumeurs des ovaires et d’autres organes reproducteurs, bénignes comme malignes, ont été signalées chez des femmes ayant reçu un traitement pour infertilité pendant plusieurs cycles.
Porphyrie
Si vous ou un membre de votre famille souffrez de porphyrie (une maladie pouvant être transmise aux enfants par les parents), veuillez en informer votre médecin avant le début du traitement, car l’utilisation de certains médicaments peut déclencher une crise de cette maladie.
Veuillez informer votre médecin si vous remarquez que votre peau devient vulnérable et que des cloques ont tendance à se former rapidement (particulièrement aux endroits souvent exposés aux rayons du soleil) et/ou si vous avez des douleurs au ventre ou des courbatures. Il vous recommandera éventuellement d’arrêter le traitement.
Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement «sans sodium».
Veuillez informer votre médecin ou votre pharmacien si
– vous souffrez d’une autre maladie
– vous êtes allergique
– vous prenez déjà d’autres médicaments (même en automédication!).
Luveris peut-il être pris/utilisé pendant la grossesse ou l’allaitement ?
Vous ne devez pas utiliser Luveris si vous êtes enceinte ou si vous allaitez votre enfant (voir aussi Quand Luveris ne doit-il pas être utilisé ?).
Comment utiliser Luveris ?
Votre médecin contrôle l’évolution de l’effet du médicament et décidera du dosage et de la durée de traitement adaptés à votre cas particulier. Les indications de dosage mentionnées ci-dessous ne sont donc considérées que comme des valeurs indicatives.
Luveris est destiné à être administré par voie sous-cutanée, c’est-à-dire injecté sous la peau.
En règle générale, on administre Luveris quotidiennement pendant 3 semaines au maximum, en même temps que la FSH. Lors de l’application du schéma thérapeutique habituel, on commence avec 75 UI de Luveris (un flacon) associé à 75 UI ou 150 UI de FSH.
Selon votre réponse, votre médecin augmentera la dose de Luveris jusqu’à 225 UI (3 flacons) et la dose de FSH par paliers de 37.5 UI à 75 UI à intervalles de 7 à 14 jours.
Quand la réponse désirée a été obtenue, une administration unique d’hCG est effectuée 24 à 48 heures après les dernières injections de Luveris et de FSH. On vous conseille d’avoir un rapport sexuel le jour même et le jour suivant l’administration d’hCG. Alternativement, une insémination intra-utérine (IIU) peut être pratiquée.
En cas de réponse excessive, le traitement doit être arrêté et l’hCG ne doit pas être administrée (voir Quels effets secondaires Luveris peut-il provoquer ?).
Le médecin surveillera attentivement la maturation folliculaire au moyen de prises de sang et d’examens échographiques. Il est donc important que vous suiviez exactement ses indications et ses recommandations.
Utilisation chez l’enfant et l’adolescent
Luveris ne doit pas être employé chez l’enfant et l’adolescent.
Utilisation chez les patients âgés
Luveris ne doit pas être employé chez les patients âgés.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
Instructions pour l’auto-administration
En cas d’auto-administration par injections sous-cutanées, il est indispensable de vous faire conseiller avec exactitude par votre médecin et de vous faire soigneusement initier aux modalités pratiques, afin d’assurer la meilleure efficacité possible de Luveris et d’éviter une infection. Suivez attentivement les instructions mentionnées à la fin de cette notice d’emballage.
Si vous avez utilisé plus de Luveris que vous n’auriez dû:
Les effets d’un surdosage de Luveris ne sont pas connus. Un surdosage peut entraîner une hyperstimulation des ovaires, décrite dans la rubrique Quels effets secondaires Luveris peut-il provoquer ? Ceci ne se produira toutefois que si l’hCG est administrée (voir les rubriques Quelles sont les précautions à observer lors de l’utilisation de Luveris ? et Quels effets secondaires Luveris peut-il provoquer ?).
Si vous avez oublié d’utiliser Luveris:
Ne doublez pas la dose pour compenser la dose individuelle oubliée. Veuillez contacter votre médecin.
Quels effets secondaires Luveris peut-il provoquer ?
Les effets secondaires suivants peuvent se manifester lors de l’utilisation de Luveris avec la FSH:
Les effets secondaires les plus fréquemment signalés sont: maux de tête, somnolence, réactions au site d’injection (hématome, rougeur, tuméfaction, douleurs), douleurs au bas ventre, nausées, douleurs au bassin, une hyperstimulation des ovaires (syndrome d’hyperstimulation ovarienne, SHO; voir aussi ci-dessous pour ce qui concerne les symptômes), règles douloureuses, douleurs mammaires, diarrhée, vertiges, troubles de la miction, fièvre, faiblesse, ballonnements, symptômes pseudo-grippaux, infection des voies respiratoires supérieures.
Lors d’un traitement par FSH et LH, une hyperstimulation des ovaires peut apparaître après l’administration subséquente d’hCG. Cette réaction est appelée syndrome d’hyperstimulation ovarienne ou SHO (voir Quelles sont les précautions à observer lors de l’utilisation de Luveris ?). Cette réponse excessive au traitement induit dans les ovaires le développement de volumineux kystes ovariens.
Syndrome d’hyperstimulation ovarienne (SHO)
Les premiers symptômes d’un SHO sont des douleurs au bas-ventre, éventuellement associées à des nausées et des vomissements. Dans ce contexte surviennent souvent des malaises, des diarrhées, des crampes abdominales et des ballonnements.
Un SHO peut occasionnellement devenir grave. Ceci se manifeste par des ovaires nettement hypertrophiés, une baisse de la production d’urine, une prise de poids, une respiration difficile et/ou une éventuelle accumulation de liquide dans la région abdominale et thoracique. Si l’un de ces symptômes se manifeste, adressez-vous immédiatement à votre médecin.
Indépendamment d’un SHO, des complications graves telles que des accidents thromboemboliques (caillots de sang) ont très rarement été observées. Ceci pourrait entraîner des douleurs thoraciques, un essoufflement, une attaque cérébrale ou un infarctus cardiaque.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin, votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d’emballage.
À quoi faut-il encore faire attention ?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Délai d’utilisation après ouverture
Le médicament doit être utilisé immédiatement après dissolution de la poudre.
Remarques concernant le stockage
Ne pas conserver au-dessus de 25°C.
Conserver dans l’emballage d’origine.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques complémentaires
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d’une information détaillée destinée aux professionnels.
Le contenu d’un flacon est destiné à un usage unique.
Vous ne devez pas utiliser ce médicament si vous remarquez des signes visibles de décomposition comme une altération de la couleur de la poudre ou une détérioration du récipient. La solution ne doit pas être utilisée si elle contient des particules ou si elle n’est pas limpide.
Luveris ne doit pas être mélangé avec d’autres médicaments pour une injection, sauf avec la follitropine alfa. Des études ont mis en évidence que ces deux médicaments peuvent être mélangés et injectés ensemble sans diminution de leurs effets respectifs.
Que contient Luveris ?
Luveris 75 UI, poudre et solvant pour solution injectable
Principes actifs
Un flacon de poudre contient comme principe actif 3.7 microgrammes de lutropine alfa (r-hLH produite à partir de cellules CHO (Chinese Hamster Ovary) génétiquement modifiées), correspondant à 75 UI (unités internationales).
Après reconstitution (dissolution), 75 UI peuvent être prélevées, car un peu de lutropine alfa restera dans le flacon, dans la seringue et dans l’aiguille.
Excipients
Poudre: saccharose, phosphate disodique dihydraté, phosphate monosodique monohydraté, polysorbate 20, acide phosphorique, hydroxyde de sodium, méthionine.
Un flacon de solvant contient 1 ml d’eau pour préparations injectables.
Numéro d’autorisation
55430 (Swissmedic)
Où obtenez-vous Luveris ? Quels sont les emballages à disposition sur le marché ?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Il existe des emballages de 1 ou 10 flacons de poudre accompagnés du même nombre de flacon de solvant.
Titulaire de l’autorisation
Merck (Suisse) SA, Zoug
Cette notice d’emballage a été vérifiée pour la dernière fois en janvier 2021 par l’autorité de contrôle des médicaments (Swissmedic).
Instructions pour la préparation et l’administration de la solution injectable
1) Préparations avant l’injection
– Lavez-vous les mains. Il est important que vos mains et les objets utilisés dont vous avez besoin pour l’injection soient aussi propres que possible.
– Regroupez tout ce dont vous avez besoin et placez tout le matériel sur une surface propre:
– un flacon de Luveris
– un flacon de solvant;
– deux cotons imbibés d’alcool;
– une seringue;
– une aiguille de reconstitution pour dissoudre la poudre dans le solvant, une aiguille fine pour l’injection sous-cutanée;
– un récipient pour l’élimination du verre et des aiguilles en toute sécurité.
2) Préparation du solvant pour la reconstitution

3) Préparation de la solution injectable

Trois récipients de poudre au maximum peuvent être dissous dans 1 ml de solvant.
4) Vérification des bulles d’air
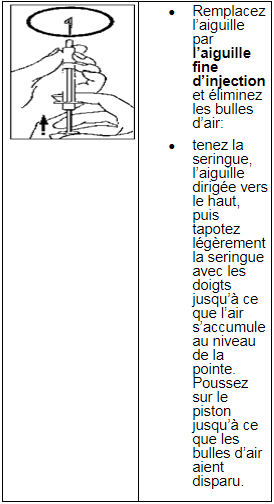
5) Injection
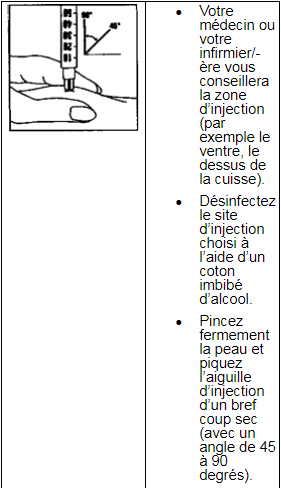

6) Après l’injection
– Retirez immédiatement l’aiguille d’injection et frottez le site d’injection circulairement avec un coton imbibé d’alcool.
– Eliminer tous les objets utilisés, les aiguilles d’injection, les récipients en verre vide et la seringue dans le récipient spécialement prévu à cet effet.
– Les restes de solution injectable inutilisés doivent être jetés.
Procédure dans le cas où votre médecin vous a prescrit Luveris avec une préparation de follitropine alfa
Vous pouvez mélanger Luveris et la follitropine alfa au lieu d’injecter les deux préparations séparément.
Après avoir dissous la poudre de Luveris, aspirez à nouveau la solution dans la seringue et injectez-la dans le récipient de poudre contenant la follitropine alfa. Une fois la poudre dissoute, aspirez à nouveau la solution dans la seringue. Comme précédemment, vérifiez que la solution ne contient pas de particules et n’utilisez pas la solution si elle n’est pas limpide. La solution injectable mixte est maintenant prête à être injectée.
Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 31.05.2021, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans un paragraphe ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 1ère mise à jour de cette page depuis le lancement début 2021 de cette rubrique.
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


