Tafinlar®, comprimé pour suspension buvable
Information destinée aux patients en Suisse
Qu’est-ce que TAFINLAR et quand doit-il être utilisé ?
Tafinlar contient la substance active dabrafénib et inhibe la croissance des cellules cancéreuses.
– Tafinlar, seul ou en association avec Mekinist (tramétinib), est utilisé dans le traitement du cancer noir de la peau (mélanome) inopérable ou ayant formé des métastases.
– Tafinlar en association avec Mekinist (tramétinib) est utilisé également chez les patients dont le mélanome a pu être excisé chirurgicalement, afin de prévenir la réapparition du mélanome.
– Tafinlar en association avec Mekinist (tramétinib), est utilisé pour le traitement d’une forme de cancer du poumon (cancer du poumon non à petites cellules (CPNPC)).
– Tafinlar en association avec Mekinist (tramétinib) est indiqué dans le traitement de patients adultes présentant une tumeur solide non résécable ou métastatique porteuse d’une mutation BRAF-V600E, qui a progressé après un traitement antérieur et pour laquelle il n’existe pas d’autres possibilité de traitement satisfaisante.
– Les gliomes, un type de tumeurs cérébrales, chez les enfants de plus d’un an, qui nécessitent un traitement supplémentaire après des options de traitement alternatives.
Dans cette notice, il est également fait référence à la substance active tramétinib (nom commercial Mekinist), car elle peut être administrée en association avec Tafinlar (dabrafénib). Veuillez lire attentivement la notice d’emballage de Mekinist (tramétinib) en plus de la présente notice d’emballage.
Tafinlar en monothérapie ou en association avec Mekinist (tramétinib) ne peut être utilisé que chez les personnes dont le cancer présente une certaine modification (mutation) sur le gène dit BRAF. Tafinlar et Mekinist (tramétinib) agissent sur les protéines que l’organisme synthétise en raison de ce gène modifié, ralentissant ou stoppant ainsi le développement de votre cancer. Votre médecin prélèvera un échantillon de tissu tumoral afin de déterminer si le traitement par Tafinlar ou Tafinlar en association avec Mekinist (tramétinib) est possible dans votre cas.
Selon prescription du médecin.
Quand TAFINLAR ne doit-il pas être pris/utilisé ?
Tafinlar ne doit pas être utilisé en cas d’hypersensibilité à la substance active dabrafénib ou à l’un des excipients.
Quelles sont les précautions à observer lors de la prise/de l’utilisation de TAFINLAR ?
Si votre cancer est traité par une association de Tafinlar et de Mekinist (tramétinib), veuillez également lire attentivement la notice d’emballage de Mekinist (tramétinib). Tafinlar ne doit pas être utilisé en association avec le tramétinib chez des patients porteurs de tumeurs à gène BRAF de type sauvage ou d’un carcinome colorectal.
Avant et pendant que vous prenez Tafinlar, votre médecin doit savoir:
– si vous avez ou avez eu des problèmes de reins ou de foie Discutez des problèmes hépatiques existants avec votre médecin. Il ou elle contrôlera donc régulièrement vos paramètres hépatiques avant et pendant le traitement.
– si vous souffrez de diabète Dans ce cas, votre médecin surveillera plus étroitement votre glycémie.
– si vous ressentez de fortes douleurs inexpliquées dans la partie supérieure de l’abdomen. Votre médecin vous examinera pour déterminer si vous avez une inflammation du pancréas (pancréatite). S’il est confirmé que vous avez une pancréatite, votre médecin effectuera des analyses de sang régulières.
– si vous avez un problème oculaire appelé uvéite (il s’agit d’une inflammation de la membrane interne de l’œil, qui, en l’absence de traitement, peut altérer l’acuité visuelle). L’uvéite peut se développer rapidement. Les symptômes sont:
– rougeur et irritation oculaires
– vision floue
– douleur oculaire
– sensibilité accrue à la lumière
– points flottants devant l’œil
Il est important de contacter immédiatement votre médecin si vous présentez ces symptômes, en particulier si vous avez un œil rouge douloureux qui ne se rétablit pas rapidement. Il peut être nécessaire de faire appel à un spécialiste de la vue.
– si vous avez une température corporelle élevée de manière persistante, qui peut être accompagnée de frissons intenses, de déshydratation et d’hypotension. Si vous développez une fièvre avec une température supérieure à 38 °C, contactez immédiatement votre médecin. Il ou elle effectuera des tests pour déterminer s’il y a d’autres causes à la fièvre et traitera le problème.
– pendant et après des épisodes de fièvre sévères, certaines substances (enzymes) peuvent présenter des taux anormalement élevés; votre médecin mesurera les taux d’enzymes et vérifiera que vos reins fonctionnent correctement.
– si vous présentez des saignements, en particulier si vous présentez les signes suivants d’une hémorragie intracrânienne: sensation de vertiges, nausées, vomissements, vertiges, maux de tête extrêmement violents et raideur de la nuque.
– si vous ressentez des douleurs thoraciques, un essoufflement soudain, des difficultés à respirer, des douleurs dans les jambes avec ou sans gonflement, un gonflement du bras ou de la jambe ou un bras ou une jambe froids et pâles, car il peut s’agir de signes d’un caillot de sang dans les veines du bras ou de la jambe, des poumons ou d’autres parties du corps.
– si vous présentez simultanément plusieurs symptômes, tels que fièvre, gonflement des ganglions, hématomes ou éruption cutanée. Ces symptômes peuvent être le signe d’une lymphohistiocytose hémophagocytaire (LHH), une maladie lors de laquelle le système immunitaire produit trop de cellules de défense contre les infections (appelées histiocytes et lymphocytes).
– si vous présentez simultanément plusieurs symptômes, tels qu’un rythme cardiaque irrégulier, une diminution de l’excrétion de l’urine, une confusion, de fortes nausées et des vomissements, un essoufflement, des crampes ou contractions musculaires, qui peuvent être les signes d’un syndrome de lyse tumorale ou SLT, un trouble dû à la dégradation rapide des cellules cancéreuses.si vous souffrez d’un déficit en glucose-6-phosphate déshydrogénase (G6PD). Dans ce cas, votre médecin vous surveillera plus étroitement afin de détecter une éventuelle anémie.
– si vous avez des problèmes de peau, par exemple un rash cutané ou des manifestations acnéiques.
– si vous remarquez des modifications de votre peau, par exemple:
– nouvelles verrues
– peau rugueuse/blessée ou bosses rougeâtres qui saignent ou ne guérissent pas
– changement de taille ou de couleur d’un grain de beauté.
Si vous constatez des modifications de la peau pendant le traitement par Tafinlar, vous devez en informer votre médecin le plus rapidement possible. Jusqu’à une personne sur 10 prenant Tafinlar peut développer un autre type de cancer de la peau. Normalement, ces lésions restent localisées, peuvent être enlevées chirurgicalement et le traitement par Tafinlar peut être poursuivi.
Certaines personnes prenant Tafinlar peuvent éventuellement observer l’apparition de nouveaux mélanomes. Normalement, ces lésions peuvent être enlevées chirurgicalement et le traitement peut être poursuivi.
Votre médecin examinera votre peau avant le traitement par Tafinlar, tous les 2 mois pendant le traitement, et tous les 2–3 mois pendant 6 mois après l’arrêt du traitement.
Votre médecin peut vous examiner avant, pendant et après le traitement par Tafinlar afin d’exclure le développement d’un autre cancer chez vous.
Parlez à votre médecin si vous pensez que l’une des maladies mentionnées ci-dessus est présente chez vous ou se manifeste pendant le traitement par Tafinlar.
Des réactions cutanées graves ont été observées chez des patients prenant Tafinlar en même temps que Mekinist:
– rash, rougeurs cutanées, formation de cloques sur les lèvres, les yeux ou dans la bouche, desquamation de la peau avec ou sans fièvre; il peut s’agir de signes possibles d’un syndrome de Stevens-Johnson.
– rash cutané étendu, fièvre et ganglions lymphatiques hypertrophiés (il peut s’agir de signes d’un exanthème médicamenteux avec éosinophilie et symptômes systémiques (DRESS)).
Si vous remarquez des modifications de la peau pendant la prise de Tafinlar, vous devez en informer votre médecin le plus rapidement possible (voir «Quels effets secondaires Tafinlar peut-il provoquer ?»).
Les hommes peuvent avoir un nombre réduit de spermatozoïdes pendant un traitement par Tafinlar. Il se peut que celui-ci ne revienne pas à des valeurs normales après l’arrêt du médicament. Pour toute autre question à ce sujet, veuillez contacter votre médecin ou votre pharmacien.
L’utilisation simultanée de Tafinlar et d’autres médicaments peut entraîner un renforcement ou une diminution des effets (souhaités et indésirables) de Tafinlar ou une augmentation des effets des autres médicaments. Parmi ces médicaments, on trouve par exemple:
certains antibiotiques, fongicides, médicaments contre le VIH (SIDA) ou médicaments de type cortisone, médicaments contre l’épilepsie, antidépresseurs, certains anticoagulants, contraception hormonale (pilule, injections, patch), médicaments pour réduire les lipides sanguins ainsi que les médicaments pour réduire l’acidité gastrique. Informez votre médecin si vous utilisez d’autres médicaments. Il ou elle décidera ceux que vous pouvez utiliser en même temps que Tafinlar et de la dose de Tafinlar que vous devez prendre.
Tafinlar, seul ou en association avec Mekinist (tramétinib), peut entraîner une aggravation de certaines maladies préexistantes ou provoquer des effets secondaires graves. Vous devez donc savoir quels sont les signes et symptômes importants auxquels vous devez faire attention pendant le traitement (voir aussi: «Quels effets secondaires Tafinlar peut-il provoquer ?»; prise de Tafinlar ou prise de Tafinlar en association avec Mekinist (tramétinib)).
Tafinlar et Mekinist (tramétinib) ne sont pas recommandés chez les patients pédiatriques âgés de moins d’un an.
Chaque comprimé pour suspension buvable contient < 0,00078 mg d’alcool benzylique. L’alcool benzylique peut provoquer des réactions allergiques.
Ne pas utiliser au-delà d’une semaine chez le jeune enfant (de moins de 3 ans), sauf sur l’avis de votre médecin ou de votre pharmacien.
Si vous êtes enceinte ou allaitez, consultez votre médecin ou votre pharmacien, car des quantités importantes d’alcool benzylique peuvent s’accumuler dans votre corps et provoquer des effets secondaires (appelés «acidose métabolique»)
Si vous souffrez d’une affection du foie ou des reins, consultez votre médecin ou votre pharmacien, car des quantités importantes d’alcool benzylique peuvent s’accumuler dans votre corps et provoquer des effets secondaires (appelés «acidose métabolique»).
Si vous prenez d’autres médicaments, si vous avez pris récemment d’autres médicaments ou si vous avez l’intention de prendre d’autres médicaments, veuillez en informer votre médecin. Ceci s’applique également aux médicaments qui ne sont pas soumis à une prescription médicale.
Tenez une liste des médicaments que vous utilisez et présentez-la à votre médecin lorsque vous recevez un nouveau médicament.
Veuillez informer votre médecin ou votre pharmacien si
– vous souffrez d’une autre maladie
– vous êtes allergique
– vous prenez déjà d’autres médicaments (ou utilisez déjà d’autres médicaments en usage externe) (même en automédication !).
TAFINLAR peut-il être pris/utilisé pendant la grossesse ou l’allaitement ?
L’utilisation de Tafinlar, que ce soit en monothérapie ou en association avec Mekinist (tramétinib), n’est pas recommandée pendant la grossesse. Veuillez informer votre médecin avant le début du traitement si vous êtes enceinte, si vous pensez l’être ou si vous envisagez une grossesse. Il se peut qu’il ou elle vous recommande de faire un test de grossesse avant de commencer le traitement avec Tafinlar.
Tafinlar n’est pas recommandé pendant l’allaitement. On ne sait pas si les composants de Tafinlar passent dans le lait maternel. Discutez avec votre médecin de la marche à suivre si vous allaitez ou souhaitez allaiter.
Femmes en âge de procréer et patients de sexe masculin
Les femmes en âge de procréer doivent prendre des mesures contraceptives efficaces pendant un traitement par Tafinlar et pendant les deux semaines qui suivent. Comme l’efficacité des méthodes de contraception hormonales (comme la pilule, les injections ou les patchs) peut être compromise, il convient d’utiliser des méthodes supplémentaires (par exemple des préservatifs). Si vous prenez Tafinlar en association avec Mekinist, vous devez utiliser une méthode de contraception fiable pendant au moins 16 semaines après la fin du traitement combiné. Si une grossesse survient pendant le traitement par Tafinlar, le médecin doit en être informé immédiatement.
Les hommes qui prennent Tafinlar peuvent voir leur nombre de spermatozoïdes diminuer pendant la prise, et il est possible que le nombre de spermatozoïdes ne revienne pas à un niveau normal après l’arrêt de la prise de Tafinlar.
Si vous avez d’autres questions concernant l’effet de ce médicament sur le nombre de spermatozoïdes, demandez conseil à votre médecin.
Comment utiliser TAFINLAR ?
Tafinlar vous est généralement prescrit par un(e) spécialiste des tumeurs et ses instructions doivent être strictement suivies.
Chez les enfants de plus d’un an, la dose recommandée de Tafinlar, prise deux fois par jour, est déterminée par votre médecin en fonction du poids corporel.
Il est important de ne pas prendre Tafinlar en même temps qu’un repas. Tafinlar doit être pris chaque jour au même moment de la journée, soit au moins une heure avant, soit au moins deux heures après un repas.
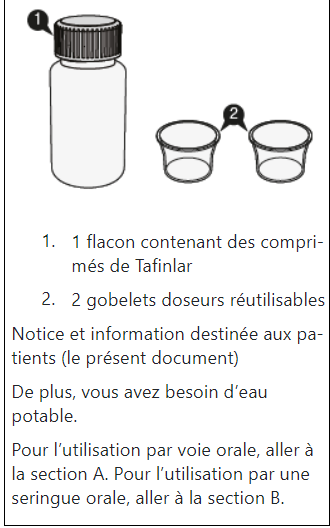
Prise de Tafinlar comprimés pour suspension buvable
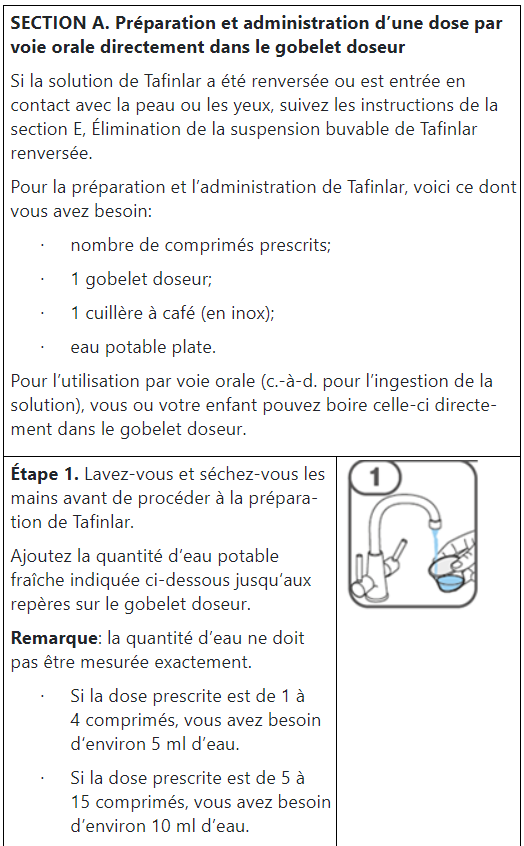
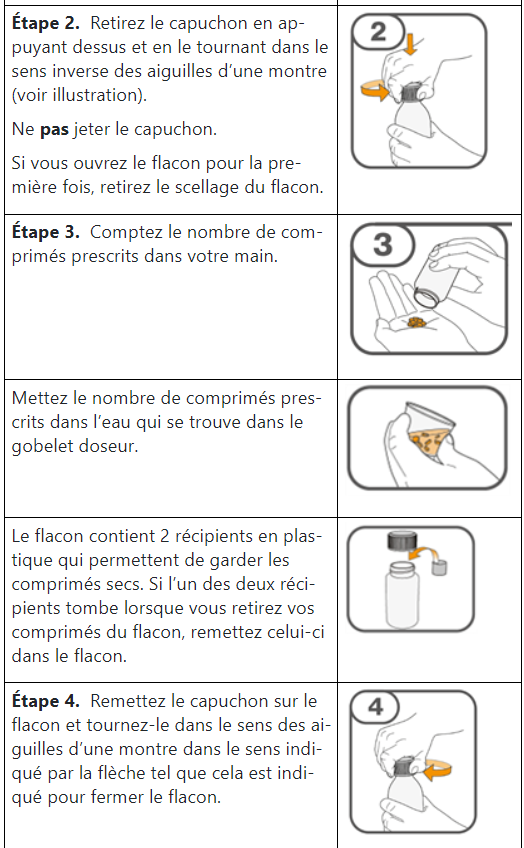
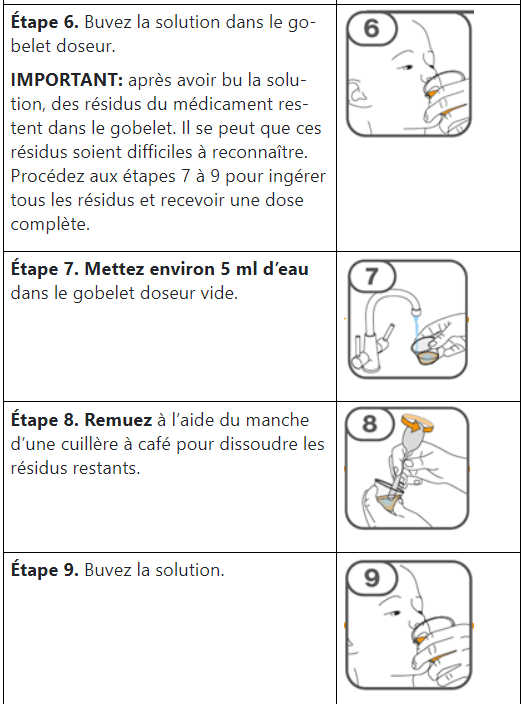
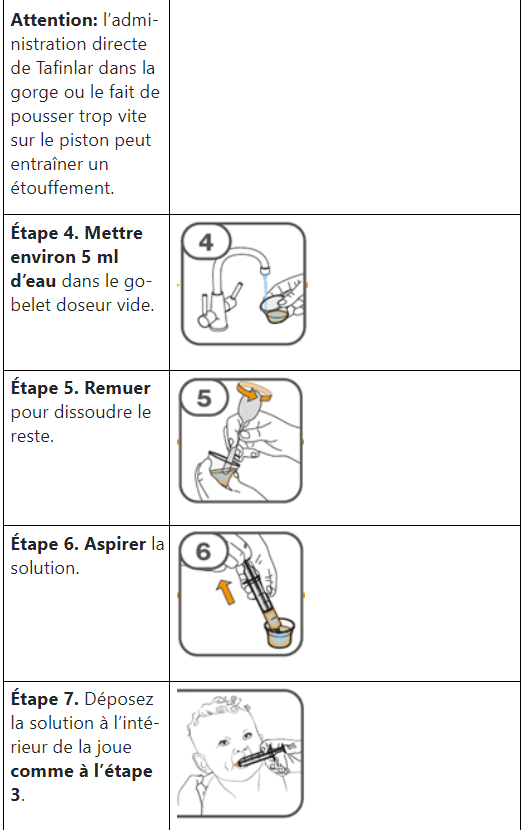
Les comprimés de Tafinlar ne doivent être pris que sous forme de suspension orale (après dissolution dans de l’eau) et ne doivent pas être avalés entiers, mâchés ou écrasés. Veuillez suivre les instructions à la fin de cette notice pour préparer et prendre la suspension. Demandez conseil à votre médecin ou à votre pharmacien en cas de doute.
Si vous présentez des effets secondaires, votre médecin peut vous prescrire une dose plus faible, interrompre le traitement ou arrêter complètement le traitement.
Si vous avez oublié une dose de Tafinlar et qu’il reste plus de 6 heures avant la prochaine prise prévue, prenez la dose oubliée. S’il reste moins de 6 heures avant la prochaine prise prévue, sautez la dose oubliée et prenez la dose suivante à l’heure habituelle.
Ne prenez jamais une double dose simultanément.
Si vous avez pris trop de capsules ou de comprimés de Tafinlar, contactez votre médecin. Si possible, montrez-lui l’emballage de Tafinlar.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
N’arrêtez pas de prendre ce médicament, sauf si votre médecin vous le conseille.
Tafinlar n’est pas recommandé chez les patients pédiatriques âgés de moins d’un an.
Quels effets secondaires TAFINLAR peut-il provoquer ?
Prise de Tafinlar
Soyez attentif aux symptômes suivants:
Fièvre: Tafinlar peut provoquer de la fièvre. Informez immédiatement votre médecin ou votre pharmacien en cas de température corporelle élevée de manière durable pendant le traitement par Tafinlar. Il ou elle déterminera, à l’aide de tests, si la fièvre a d’autres causes et traitera le problème. Dans certains cas, les personnes fiévreuses peuvent développer une hypotension et des vertiges. Si la fièvre est sévère, votre médecin peut éventuellement arrêter temporairement le traitement par Tafinlar.
Si les symptômes suivants apparaissent, il faut en informer immédiatement le médecin: douleurs abdominales aiguës, nausées ou vomissements, respiration rapide et profonde, malaise, perte d’appétit et/ou de poids. Il peut s’agir de signes d’alerte précoces d’un effet indésirable naissant qui, s’il se développe, peut mettre la vie en danger, comme une pancréatite.
Très fréquent (concerne plus d’un utilisateur sur 10)
Épaississement de la peau, problèmes cutanés (rash cutané, excroissances semblables à des verrues, qui peuvent également dégénérer de manière maligne, rougeurs, gonflements de la paume des mains, des doigts et de la plante des pieds), maux de tête, diarrhée, nausées, vomissements, perte d’appétit, constipation, frissons, fièvre, toux, faiblesse, manque d’énergie, apathie, douleurs articulaires, douleurs musculaires ou douleurs aux mains et aux pieds, perte de cheveux inhabituelle ou raréfaction des cheveux.
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Douleurs thoraciques, essoufflement soudain, difficultés à respirer, douleurs dans les jambes avec ou sans gonflement, un gonflement du bras ou de la jambe ou un bras ou une jambe froids et pâles; il peut s’agir de signes d’un caillot de sang dans les veines du bras ou de la jambe, des poumons ou d’autres parties du corps.
Symptômes pseudo-grippaux, inflammation du rhinopharynx, diminution du phosphore sanguin, augmentation de la glycémie, problèmes cutanés (sécheresse, rougeur, épaississement brun ou jaunâtre de la peau, appendices cutanés, taches rugueuses et squameuses sur la peau, démangeaisons), photosensibilité, insuffisance rénale, diminution de la performance cardiaque, arythmie cardiaque, problèmes nerveux pouvant provoquer des douleurs, une perte de sensations ou un fourmillement dans les mains et les pieds/une faiblesse musculaire (neuropathie périphérique).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Inflammation de l’oeil (uvéite), inflammation du pancréas (qui peut s’accompagner de fortes douleurs abdominales; votre médecin surveillera étroitement votre pancréas en cas d’apparition d’une inflammation), inflammation du tissu adipeux sous la peau (qui peut s’accompagner de zones cutanées nodales et douloureuses), réaction allergique, nouveau mélanome.
Rare (concerne 1 à 10 utilisateurs sur 10 000)
Inflammation du rein
Prise de Tafinlar en association avec Mekinist (tramétinib)
Lisez également attentivement la notice de Mekinist (tramétinib) pour connaître les effets secondaires tels que les maladies cardiaques et les problèmes oculaires (troubles visuels).
Saignements: la prise de Tafinlar en association avec Mekinist peut provoquer des hémorragies graves, notamment dans le cerveau ou l’estomac. Appelez votre médecin ou votre infirmier/ère et demandez immédiatement une aide médicale si vous présentez des signes inhabituels de saignement, par exemple:
– Maux de tête, vertiges ou faiblesse
– Crachats de sang ou de caillots sanguins
– Vomissements contenant du sang ou ressemblant à du marc de café
– Saignements de nez
– Selles rouges ou noires, ressemblant à du goudron
Modifications de la peau:
Si vous constatez des modifications de la peau, vous devez en informer votre médecin le plus rapidement possible. Des réactions cutanées graves ont été rapportées chez des patients traités par Tafinlar associé à Mekinist. Veuillez prêter attention aux signes suivants:
– rougeurs rondes avec une vésicule au centre, desquamation de la peau,
– ulcères (appelés ulcérations) dans la bouche, la gorge, le nez, la région des yeux et les parties intimes. Ces rash cutanés graves peuvent être précédés de fièvre et de symptômes pseudo-grippaux (syndrome de Stevens-Johnson).
– rash cutanés étendus, fièvre et ganglions lymphatiques hypertrophiés (syndrome DRESS ou réaction d’hypersensibilité médicamenteuse)
Si les modifications ou les symptômes mentionnés ci-dessus apparaissent, le traitement par Tafinlar et Mekinist doit être immédiatement arrêté.
Effets secondaires possible chez les enfants lors de la prise de Tafinlar en association avec Mekinist:
Très fréquent (concerne plus d’un utilisateur sur 10)
Réduction du nombre d’un type de globule blanc (neutropénie), inflammations cutanées de type acnéique, inflammation du lit de l’ongle (paronychie), anémie, réduction du nombre global de globules blancs (leucopénie), prise de poids, élévation des valeurs des transaminases.
Inflammation du nez et de la gorge, diminution de l’appétit, maux de tête, sensation vertigineuse, pression artérielle élevée (hypertension), saignements (hémorragies, généralement légères, mais pouvant aller jusqu’à des hémorragies fatales), toux, nausées, diarrhée, vomissements, maux de ventre (douleurs abdominales), constipation, valeurs hépatiques inhabituelles (augmentation de l’alanine aminotransférase, augmentation de l’aspartate aminotransférase), rash cutané, peau sèche, démangeaisons, rougeur de la peau (érythème), douleurs articulaires (arthralgie), douleurs musculaires (myalgie), douleurs dans les mains et les pieds, crampes musculaires, fièvre, fatigue, frissons, gonflement des mains et des pieds (syndrome mains-pieds), manque d’énergie, sensation de faiblesse (asthénie), état grippal.
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Rougeur et desquamation de la peau sur de larges zones du corps (dermatite exfoliative généralisée), hypersensibilité, inflammation du pancréas (pancréatite), infection des voies urinaires, infection de la peau (cellulite), inflammation de la cavité nasopharyngienne (rhinopharyngite),inflammation des follicules pileux dans la peau (folliculite), douleurs des ongles, infection et gonflement des cuticules, effets sur la peau, par ex. des zones de peau fragile et squameuse, un rash cutané avec des vésicules purulentes, un cancer épidermoïde cutané (un type de cancer de la peau), un papillome (un type de tumeur cutanée généralement bénigne), un épaississement brun ou jaunâtre de la peau (kératose et hyperkératose), diminution du nombre de plaquettes – cellules qui aident le sang à coaguler (thrombopénie), manque d’eau dans l’organisme (déshydratation), faible taux de sodium dans le sang (hyponatrémie), faible taux de phosphate dans le sang (hypophosphatémie), soif excessive, grande quantité d’urine, urines foncées, augmentation de l’appétit avec perte de poids, peau sèche et rouge, irritabilité comme signe d’un taux élevé de sucre (glucose) dans le sang (signe d’hyperglycémie), vision floue, détérioration de la vue, inflammation de l’œil (uvéite), pompage moins efficace du cœur (réduction de la fraction d’éjection), ralentissement des battements cardiaques (bradycardie), pression artérielle basse (hypotension), accumulation de liquide dans les extrémités (lymphœdème), essoufflement (dyspnée), bouche sèche, inflammation des muqueuses buccales (stomatite), augmentation de certaines substances produites par le foie (enzymes telles que la gamma-glutamyltransférase et la phosphatase alcaline), sueurs nocturnes, perte des cheveux inhabituelle ou raréfaction des cheveux (alopécie), excroissances de type verruqueux ou rougeurs et gonflements de la paume des mains, des doigts et de la plante des pieds, lésions de la peau (lésions cutanées), craquelures cutanées, transpiration excessive, inflammation du tissu graisseux sous la peau (panniculite), sensibilité à la lumière, augmentation de la créatine phosphokinase dans le sang, une enzyme qui se trouve surtout dans le cœur, le cerveau et les muscles squelettiques, insuffisance rénale (maladie des reins, qui peut entraîner une limitation de l’élimination de l’urine) et insuffisance rénale aiguë, inflammation des muqueuses (pas seulement dans la bouche), gonflement local des tissus, par ex., gonflement du visage (œdème du visage), rythme cardiaque irrégulier (bloc de branche).
Douleurs dans la poitrine, essoufflement soudain, difficultés respiratoires, douleurs dans les jambes avec ou sans gonflement, gonflement d’un bras ou d’une jambe ou un bras ou une jambe froid(e) et plus pâle; il peut s’agir de signes d’un caillot sanguin dans une veine du bras ou de la jambe, des poumons ou d’une autre partie du corps, problèmes nerveux pouvant provoquer des douleurs, une perte de sensations ou un fourmillement dans les mains et les pieds/une faiblesse musculaire (neuropathie périphérique).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Nouveau mélanome primaire, fibromes (verrues pédiculaires), sarcoïdose (maladie inflammatoire touchant principalement les voies respiratoires, la peau, le cœur et les yeux), réactions allergiques aux médicaments, modifications oculaires, par ex. gonflement de l’œil causé par une fuite de liquide (choriorétinopathie), décollement de la membrane photosensible à l’arrière de l’œil (la rétine) des couches de support (décollement de l’épithélium pigmentaire rétinien/décollement de la rétine), gonflement dans la région de l’œil, ralentissement du rythme cardiaque (bradycardie), pneumonie (pneumopathie inflammatoire) et autres maladies pulmonaires (pneumopathie interstitielle diffuse), inflammation du pancréas, diarrhée, douleurs abdominales, fièvre (signes de colite), fortes douleurs à l’estomac, nausées (signes d’une perforation gastrique ou intestinale), inflammation des reins, modification de la manière dont le cœur pompe le sang (dysfonctionnement du ventricule gauche), insuffisance cardiaque (diminution de la fonction cardiaque pouvant entraîner des problèmes respiratoires en position couchée, fatigue ou gonflement des jambes), destruction du tissu musculaire (rhabdomyolyse) pouvant entraîner des douleurs, de la fièvre et une urine rouge-brun. Rythme cardiaque irrégulier (bloc de branche).
Rare (concerne 1 à 10 utilisateurs sur 10 000)
Inflammation du tissu du muscle cardiaque, inflammation du muscle cardiaque (myocardite), pouvant entraîner des difficultés respiratoires, de la fièvre, des palpitations ou des tachycardies et des douleurs dans la poitrine, peau enflammée et squameuse (dermatite exfoliative), perforation de l’estomac ou de l’intestin (perforation gastro-intestinale).
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
Lymphohistiocytose hémophagocytaire (une affection lors de laquelle le système immunitaire produit trop de cellules de défense contre les infections), plusieurs symptômes survenant simultanément, tels qu’un rythme cardiaque irrégulier, une diminution de l’excrétion de l’urine, une confusion, de fortes nausées et des vomissements, un essoufflement, des crampes ou contractions musculaires («syndrome de lyse tumorale» ou SLT).
Effets secondaires possibles chez les adultes lorsque Tafinlar est pris en même temps que Mekinist
Dans l’ensemble, les effets indésirables observés chez les enfants étaient similaires à ceux observés chez les adultes. D’autres effets secondaires sont apparus plus rarement chez les adultes que chez les enfants:
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Réduction du nombre d’un type de globule blanc (neutropénie), inflammations cutanées de type acnéique, inflammation du lit de l’ongle (paronychie), anémie, réduction du nombre global de globules blancs (leucopénie).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Ralentissement des battements cardiaques (bradycardie), rougeur et desquamation de la peau sur de larges zones du corps (dermatite exfoliative généralisée), hypersensibilité et inflammation du pancréas (pancréatite)
Si vous remarquez des effets secondaires qui ne sont pas décrits ici, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention ?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Comprimés pour suspension buvable
Ne pas conserver au-dessus de 30 °C.
Conserver les comprimés dans leur emballage d’origine pour les protéger de l’humidité. Ne pas enlever le dessicant. Conserver hors de la portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d’une information détaillée destinée aux professionnels.
Que contient TAFINLAR ?
Principes actifs
1 comprimé pour suspension buvable contient 10 mg de dabrafénib (sous forme de mésylate de dabrafénib)
Excipients
Mannitol (E421), cellulose microcristalline, crospovidone, hypromellose (E464), acésulfame de potassium, stéarate de magnésium, arôme artificiel de baies (contient de l’alcool benzylique), dioxyde de silicium colloïdal.
Numéro d’autorisation
69135 (Swissmedic)
Où obtenez-vous TAFINLAR ? Quels sont les emballages à disposition sur le marché ?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Tafinlar 10 mg comprimés pour suspension buvable: Emballages de 210 comprimés. Chaque emballage est accompagné de 2 gobelets doseurs.
Titulaire de l’autorisation
Novartis Pharma Schweiz AG, Risch; domicile: 6343 Rotkreuz.
Cette notice d’emballage a été vérifiée pour la dernière fois en avril 2024 par l’autorité de contrôle des médicaments (Swissmedic).
Remarques concernant l’utilisation et la manipulation










Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 05.06.2024, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans le paragraphe en gras juste ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 2ème mise à jour de cette page depuis le lancement début 2021 de cette rubrique. Mise à jour 1 (janvier 2024).
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


