Vitrakvi® gélules/solution buvable
Information destinée aux patients en Suisse
Qu’est-ce que VITRAKVI et quand doit-il être utilisé ?
Selon prescription du médecin.
VITRAKVI contient le principe actif larotrectinib.
VITRAKVI est utilisé chez les adultes, les adolescents, les enfants et les enfants en bas âge à partir de 28 jours.
VITRAKVI est utilisé dans le traitement du cancer (tumeurs).
VITRAKVI est uniquement utilisé:
– lorsqu’une tumeur présente un défaut génétique spécifique (appelé fusion du gène NTRK).
– lorsque la tumeur s’est propagée ou lorsqu’une intervention chirurgicale visant à retirer la tumeur risquerait d’entraîner de graves complications et
– lorsqu’il n’existe aucune option thérapeutique satisfaisante ou lorsque la tumeur a de nouveau grossi après le traitement précédent.
Un cancer avec une fusion du gène NTRK peut apparaître dans de nombreuses parties du corps. VITRAKVI peut réduire la croissance du cancer.
Avant de vous donner VITRAKVI, votre médecin réalisera un test pour vérifier que vous présentez bien la modification du gène NTRK.
Si vous avez des questions sur le fonctionnement de VITRAKVI ou sur les raisons pour lesquelles ce médicament vous a été prescrit, veuillez interroger votre médecin, votre pharmacien ou votre infirmier/ère.
Quand VITRAKVI ne doit-il pas être pris/utilisé ?
Ne prenez pas VITRAKVI si vous êtes allergique au larotrectinib ou à l’un des autres composants contenus dans VITRAKVI.
Quelles sont les précautions à observer lors de la prise/de l’utilisation de VITRAKVI ?
Veuillez informer immédiatement votre médecin, votre pharmacien ou votre infirmier/ère, si vous présentez pendant le traitement l’un des symptômes suivants:
– troubles du système nerveux, p.ex. étourdissements, maux de tête, difficultés ou incapacité à marcher normalement, troubles de la perception, troubles de la coordination, tremblement, névralgies, picotements, sensation d’engourdissement, sensibilité accrue au toucher ou à la pression, ou sensation de brûlure dans les mains et les pieds.
La survenue de tels symptômes peut affecter les réactions, l’aptitude à conduire et la capacité à utiliser des outils ou des machines. Dans ces cas, vous ne devez donc pas conduire de véhicules (également les deux-roues) et ne pas utiliser de machines.
– Problèmes hépatiques, y compris des anomalies des tests hépatiques, avec les signes possibles suivants: jaunissement de la peau ou de la partie blanche des yeux (jaunisse), urines foncées ou brunes, douleurs dans la partie supérieure droite de l’abdomen, hématomes ou saignements plus fréquents ou plus faciles que la normale, fatigue, nausées ou vomissements, ou perte d’appétit.
– Fractures, signes ou symptômes d’une fracture potentielle (p.ex. douleurs, restriction de la liberté de mouvement, déformation).
VITRAKVI peut avoir un effet nocif sur le foie (peut augmenter la quantité dans le sang de certaines substances produites par le foie). Votre médecin réalisera des tests sanguins avant et pendant le traitement pour surveiller la concentration de ces substances et pour contrôler le fonctionnement de votre foie.
Votre médecin peut décider de réduire la dose de VITRAKVI, d’interrompre ou d’arrêter définitivement le traitement par VITRAKVI (voir également rubrique «Quels effets secondaires VITRAKVI peut-il provoquer ?»).
Informations importantes concernant certains excipients contenus dans VITRAKVI solution buvable:
– Sodium: VITRAKVI solution buvable contient moins de 1 mmol de sodium (23 mg) par 5 ml, c.-à-d. qu’il est pratiquement «sans sodium».
– Hydroxypropylbétadex: Ce médicament contient 873 mg de cyclodextrine par 5 ml équivalent à 174,6 mg par ml. Ne pas utiliser chez l’enfant de moins de 2 ans sauf recommandation contraire de votre médecin.
– Benzoate de sodium: ce médicament contient 2 mg d’acide benzoïque par ml. L’acide benzoïque peut accroître le risque ictère (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu’à 4 semaines).
– L’arôme de fraise contenu dans VITRAKVI solution buvable contient de l’alcool benzylique, 0,325 mg maximum par 5 ml, équivalent à 0,065 mg/ml. L’alcool benzylique peut provoquer des réactions allergiques. L’alcool benzylique est associé à un risque d’effets secondaires graves y compris des problèmes respiratoires (appelés «syndrome de suffocation») chez les nouveau-nés. Ne pas utiliser chez le nouveau-né (jusqu’à 4 semaines) sauf recommandation contraire de votre médecin. Ne pas utiliser pendant plus d’une semaine chez les jeunes enfants (moins de 3 ans), sauf avis contraire de votre médecin ou de votre pharmacien. Demandez conseil à votre médecin ou à votre pharmacien si vous êtes enceinte ou si vous allaitez, ou si vous souffrez d’une maladie du foie ou du rein. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés «acidose métabolique»).
Informez votre médecin, votre pharmacien ou votre infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Certains médicaments peuvent modifier l’effet de VITRAKVI. Inversement, VITRAKVI peut modifier l’effet d’autres médicaments et provoquer des effets secondaires graves. En particulier, informez votre médecin ou votre pharmacien si vous prenez l’un des médicaments mentionnés ci-dessous (la dose devra être éventuellement adaptée):
– médicaments utilisés pour traiter les infections fongiques (itraconazole, kétoconazole, posaconazole, voriconazole)
– médicaments utilisés pour traiter les infections bactériennes (clarithromycine, télithromycine, troléandomycine, rifabutine et rifampicine)
– médicaments utilisés pour traiter l’infection par le VIH (atazanavir, indinavir, nelfinavir, ritonavir, saquinavir)
– médicament et produit thérapeutique à base de plantes utilisés pour traiter la dépression (néfazodone, millepertuis)
– médicaments utilisés pour traiter les crises d’épilepsie (phénytoïne, carbamazépine et phénobarbital)
– analgésique narcotique (alfentanil)
– médicaments utilisés pour prévenir le rejet d’organe suite à une greffe d’organe (ciclosporine, sirolimus, tacrolimus)
– médicament utilisé pour traiter les douleurs chroniques (fentanyl)
Ne mangez pas de pamplemousse et ne buvez pas de jus de pamplemousse pendant le traitement par VITRAKVI, car ils peuvent renforcer l’effet de VITRAKVI.
Veuillez informer votre médecin ou votre pharmacien si
– vous souffrez d’une autre maladie,
– vous êtes allergique
– vous prenez ou utilisez déjà d’autres médicaments en usage externe (même en automédication!).
VITRAKVI peut-il être pris/utilisé pendant la grossesse ou l’allaitement ?
Si vous êtes enceinte ou pourriez tomber enceinte, si vous allaitez, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. Si vous êtes susceptible de tomber enceinte, votre médecin doit réaliser un test de grossesse avant le début du traitement par VITRAKVI.
VITRAKVI ne doit pas être pris pendant la grossesse, sauf en cas de nécessité absolue.
Vous ne devez pas tomber enceinte pendant le traitement par VITRAKVI. En raison du mécanisme d’action de VITRAKVI, le risque de lésions irréversibles ou d’anomalies congénitales chez l’enfant ne peut être exclu.
De plus, vous devez utiliser une méthode de contraception hautement efficace pendant le traitement par VITRAKVI et pendant au moins 1 mois après la dernière prise. Demandez conseil à votre médecin concernant la meilleure méthode de contraception pour vous. Informez votre médecin si vous pensez être enceinte ou planifiez une grossesse.
Prévenez immédiatement votre médecin si vous tombez enceinte pendant le traitement par VITRAKVI ou lors du premier mois qui suit la prise de la dernière dose.
Vous ne devez pas allaiter pendant le traitement par VITRAKVI et pendant 3 jours après la dernière prise, car on ignore si VITRAKVI passe dans le lait maternel. Demandez à votre médecin si et quand vous pouvez à nouveau allaiter.
Hommes en capacité de procréer (patients) ayant des partenaires en âge de procréer: votre partenaire ne doit pas tomber enceinte pendant le traitement par VITRAKVI. En raison du mécanisme d’action de VITRAKVI, le risque de lésions irréversibles ou d’anomalies congénitales chez l’enfant ne peut être exclu. Vous devez utiliser une méthode de contraception hautement efficace pendant le traitement par VITRAKVI et pendant au moins 1 mois après la dernière prise. Demandez conseil à votre médecin concernant la meilleure méthode de contraception pour vous.
Comment utiliser VITRAKVI ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou de votre pharmacien. Il est important de prendre VITRAKVI aussi longtemps que votre médecin vous l’a prescrit. Contactez votre médecin ou votre pharmacien si vous avez des questions sur l’utilisation de ce médicament.
Posologie
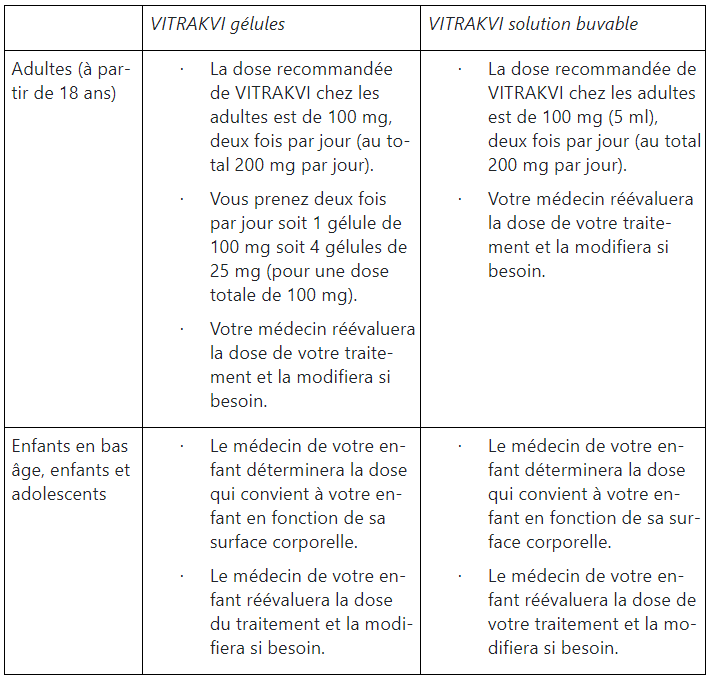
Ce médicament ne doit pas être administré aux nouveau-nés âgés de moins de 28 jours, car on ignore si VITRAKVI est sûr et efficace chez des enfants de ce groupe d’âge.
Prise de VITRAKVI
VITRAKVI est disponible sous forme de gélules et en solution buvable. Les deux formes sont interchangeables. VITRAKVI peut être pris avec ou sans aliments. VITRAKVI ne doit pas être pris en même temps que du jus de pamplemousse (voir également rubrique «Quelles sont les précautions à observer lors de la prise/de l’utilisation de VITRAKVI ?»).
Gélules: les gélules de VITRAKVI doivent être avalées entières avec de l’eau. La gélule ne doit être ni ouverte, ni mâchée, ni écrasée en raison de son goût amer.
Solution buvable: la solution buvable est administrée par la bouche au moyen d’une seringue doseuse (voir également la rubrique «Instructions d’utilisation»). Si besoin, la solution buvable peut être administrée par une sonde d’alimentation naso-gastrique. Pour plus d’informations, veuillez vous adresser à votre médecin, votre pharmacien ou votre infirmier/ère.
Si vous vomissez après la prise de VITRAKVI
Ne prenez pas de dose supplémentaire et prenez la dose suivante à l’heure habituelle.
Si vous avez pris plus de VITRAKVI que vous n’auriez dû
Informez sans tarder votre médecin, votre pharmacien ou votre infirmier/ère. Emportez la boîte du médicament et cette notice d’emballage avec vous. Le risque que vous présentiez les effets indésirables décrits à la rubrique «Quels effets secondaires VITRAKVI peut-il provoquer ?» pourrait être accru.
Si vous oubliez une dose de VITRAKVI
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre. Prenez la dose suivante à l’heure habituelle.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires VITRAKVI peut-il provoquer ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Très fréquent (concerne plus d’un utilisateur sur 10)
Étourdissements, douleurs (y compris maux de tête, douleurs gastro-intestinales et abdominales, ou douleurs articulaires ou musculaires), troubles de la perception, toux, détresse respiratoire, nez bouché, vomissements, constipation, diarrhée, nausées, élévation des enzymes hépatiques (alanine aminotransférase et aspartate aminotransférase) mise en évidence par des analyses de sang, éruption cutanée, concentration accrue de créatinine (une substance qui est normalement éliminée dans l’urine par les reins) dans le sang, troubles de l’humeur, infection des voies urinaires, fatigue, épuisement, gonflements (œdème), fièvre, diminution du nombre de globules rouges (anémie) (entraînant fatigue, pâleur et éventuellement palpitations cardiaques), diminution du nombre des globules blancs (leucocytes, en particulier neutrophiles et lymphocytes), prise de poids, baisse de la concentration d’albumine dans le sang, diminution de l’appétit et diminution de l’ingestion de nourriture, infection virale de la muqueuse du nez et de la gorge, augmentation des taux de lipides dans le sang.
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Réaction allergique, névralgies, troubles de la sensibilité (tels que picotements, fourmillements, chatouillements, sensation d’engourdissement ou de brûlure (paresthésie, dysesthésie)), difficultés ou incapacité à marcher normalement, troubles de la coordination, vertiges rotatoires, somnolence, léthargie, tremblement, faiblesse musculaire, sensibilité diminuée ou accrue au toucher ou à la pression (hypesthésie, hyperesthésie), manque d’oxygène, accumulation de liquide dans le poumon (épanchement pleural), sinusite et congestion des sinus, rhume et troubles du nez, rhume des foins, enrouement, altération de l’acuité gustative, sensation de réplétion, reflux du contenu de l’estomac dans l’œsophage, troubles digestifs, ballonnements, sécheresse buccale, inflammation de la muqueuse buccale, caries, problèmes hépatiques pouvant être associés à des anomalies des tests hépatiques ou des taux d’acides biliaires, démangeaisons, rougeur cutanée, chute de cheveux, urticaire, acné, peau sèche, eczéma, ongles cassants, douleurs cutanées, peau sensible, cicatrisation altérée (la plaie guérit plus lentement et/ou se rouvre plus facilement), augmentation de la tension musculaire et crampes, gonflement des articulations, saignement au niveau des organes urinaires ou génitaux, présence de sang dans l’urine, élimination excessive de protéines, rétention urinaire, incontinence urinaire, retard mictionnel, troubles du sommeil, mycoses, inflammation du tissu sous-cutané (cellulite), infection des muqueuses, infection de la muqueuse de la gorge, inflammation de l’estomac, incontinence fécale, inflammation pulmonaire, troubles du rythme cardiaque, rythme cardiaque rapide, rythme cardiaque lent, palpitations ou ratés du cœur, syndrome de sevrage, douleurs thoraciques, affection pseudogrippale, accès de sueurs, frissons, douleurs au visage, malaise, gêne thoracique, manque de plaquettes sanguines, élévation du nombre de globules blancs (lymphocytes, leucocytes), diminution du poids, augmentation de l’appétit, modification de la concentration de certaines substances chimiques dans le sang (p.ex. sucre, magnésium, acide urique), tension artérielle élevée ou basse, bouffées de chaleur, troubles visuels, sensibilité à la lumière, douleurs et troubles oculaires, larmoiement accru, insuffisance thyroïdienne, acouphènes (tinnitus), maux d’oreille, troubles de l’oreille, contusion, douleurs cancéreuses, douleurs testiculaires, accumulation de liquide libre dans la cavité abdominale (ascite).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Diminution de la respiration (hypoventilation), connexion anormale entre l’intestin et la peau (fistule entérocutanée), inflammation du foie (hépatite), trouble cardiaque, sensation de froid.
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
Les effets indésirables suivants ont été signalés depuis la mise sur le marché de VITRAKVI, mais leur fréquence n’est pas connue:
problèmes hépatiques graves, y compris des anomalies des tests hépatiques, avec les signes possibles suivants:
jaunissement de la peau ou de la partie blanche des yeux (jaunisse), urines foncées ou brunes, douleurs dans la partie supérieure droite de l’abdomen, hématomes ou saignements plus fréquents ou plus faciles que la normale, fatigue, nausées ou vomissements, perte d’appétit.
fractures
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d’emballage.
À quoi faut-il encore faire attention ?
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Délai d’utilisation après ouverture
Après ouverture, VITRAKVI solution buvable peut se conserver au réfrigérateur (2-8°C) pendant une durée maximale de 10 jours.
Remarques concernant le stockage
Gélules
Conserver dans l’emballage d’origine et ne pas conserver au-dessus de 30°C. Conserver le flacon fermé. N’utilisez pas ce médicament si vous remarquez que les gélules semblent endommagées.
Solution buvable
Conserver dans l’emballage d’origine au réfrigérateur (2-8°C). Ne pas congeler. Conserver le flacon fermé. VITRAKVI solution buvable ne doit pas être administré si le flacon ou le bouchon sont endommagés ou fuient.
Conserver hors de portée des enfants.
Remarques complémentaires
Après l’arrêt du traitement, le médicament avec le reste de son contenu est à ramener à son point de vente (médecin ou pharmacien) en vue d’une élimination dans les règles.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d’une information détaillée destinée aux professionnels.
Instructions d’utilisation
Avec ce médicament, vous avez besoin d’un adaptateur pour flacon (28 mm de diamètre) et d’une seringue qui peut être utilisée pour administrer des médicaments par la bouche. Utilisez une seringue qui peut contenir 1 mL de solution et qui présente des graduations tous les 0,1 mL pour les doses de moins de 1 mL. Utilisez une seringue qui peut contenir 5 mL de solution et qui présente des graduations tous les 0,2 mL pour les doses de 1 mL ou plus.
– Appuyez sur le bouchon du flacon et tournez-le dans le sens inverse des aiguilles d’une montre pour ouvrir le flacon.
– Insérez l’adaptateur pour flacon dans le col du flacon et assurez-vous qu’il soit bien fixé.
– Poussez le piston complètement dans la seringue et placez ensuite la seringue dans l’ouverture de l’adaptateur. Retournez le flacon.
– Remplissez la seringue avec une petite quantité de solution en tirant le piston vers le bas, puis poussez à nouveau le piston vers le haut pour éliminer les bulles qui sont dans la seringue.
– Tirez le piston vers le bas jusqu’au trait de graduation correspondant à la quantité de médicament que votre médecin vous a prescrite, en mL.
– Remettez le flacon à l’endroit et retirez la seringue de l’adaptateur.
– Mettez la seringue dans la bouche, en l’orientant vers l’intérieur de la joue. Cela permet au médicament d’être avalé facilement. Appuyez lentement sur le piston.
– Remettez le bouchon du flacon et refermez le flacon soigneusement. Laissez l’adaptateur sur le flacon.
Que contient VITRAKVI ?
Principes actifs
VITRAKVI gélules contient 25 mg ou 100 mg de larotrectinib (sous forme de sulfate).
VITRAKVI solution buvable
1 ml de solution buvable contient 20 mg de larotrectinib (sous forme de sulfate).
Excipients
VITRAKVI gélules contient les excipients suivants: gélatine, dioxyde de titane (E 171), gomme-laque, laque aluminique d’indigotine (E 132), propylène glycol (E 1520) et diméticone.
Gélules de 25 mg: gélules blanches opaques en gélatine, de taille 2, avec la croix BAYER et la mention « 25 mg » imprimées en bleu sur le corps de la gélule.
Gélules de 100 mg: gélules blanches opaques en gélatine, de taille 0, avec la croix BAYER et la mention « 100 mg » imprimées en bleu sur le corps de la gélule.
VITRAKVI solution buvable
1 ml de solution buvable contient les excipients suivants: acide citrique anhydre (E330), maltodextrine, citrate de triéthyle (E1505), arôme de fraise (contient de l’alcool benzylique), propylèneglycol (E1520), hydroxypropylbétadex, benzoate de sodium (E211), citrate de sodium dihydraté (E331), sucralose (E955), eau purifiée.
Solution incolore à jaune ou orange ou rouge ou brunâtre.
Numéro d’autorisation
Gélules: 67281 (Swissmedic).
Solution buvable: 67282 (Swissmedic).
Où obtenez-vous VITRAKVI ? Quels sont les emballages à disposition sur le marché ?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
VITRAKVI gélules
Gélules de 25 mg: emballage contenant 56 gélules. (A)
Gélules de 100 mg: emballage contenant 56 gélules. (A)
VITRAKVI solution buvable
Emballage contenant 2 flacons de 50 ml. (A)
Titulaire de l’autorisation
Bayer (Schweiz) AG, Zurich.
Cette notice d’emballage a été vérifiée pour la dernière fois en septembre 2023 par l’autorité de contrôle des médicaments (Swissmedic).
Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 20.03.2024, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans le paragraphe en gras juste ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 5ème mise à jour de cette page depuis le lancement début 2021 de cette rubrique. Mise à jour 1 (juin 2021). Mise à jour 2 (juin 2022). Mise à jour 3 (septembre 2022). Mise à jour 4 (février 2023).
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


