La durée de l’immunité après avoir été infecté naturellement par la Covid-19 et chez les personnes vaccinées est une question ouverte de grande importance, surtout chez les vaccinés en ce qui concerne notamment l’application de la 3ème ou 4ème dose car au moins deux études israéliennes ont montré une claire supériorité de l’immunité naturelle (avoir eu la Covid-19 naturellement) sur le variant Delta en comparaison de la vaccination en tout cas avec les vaccins à ARN1. Pour résumer et un peu simplifier il y a deux types de défense immunitaire adaptative (celle qui survient après l’immunité innée, plus d’informations ci-dessous). Tout d’abord il y a la défense à base d’anticorps, appelée défense humorale, car pouvant attaquer directement des microbes comme des virus dans le sang. Puis la défense immunitaire à base des lymphocytes T qu’on nomme défense cellulaire, c’est-à-dire pouvant attaquer des microbes à l’intérieur des cellules. Dans ce cas, les lymphocytes T n’attaquent pas directement les virus circulant par exemple dans le sang mais les cellules infectées avec l’objectif de stopper la réplication virale dans les cellules. Il faut savoir qu’il est plus facile de mesurer la réponse immunitaire par anticorps que par les lymphocytes T. Il existe plusieurs tests sérologiques ou d’anticorps sur le marché mais à notre connaissance aucun test grand public pour mesurer les cellules T. Compter les lymphocytes T peut prendre des semaines de travail. Beaucoup d’articles ont été consacrés aux anticorps, essayons ici de mieux comprendre l’immunité cellulaire. En fin d’article nous allons aussi traiter de l’ADE, un concept très controversé et anxiogène.
Longue durée
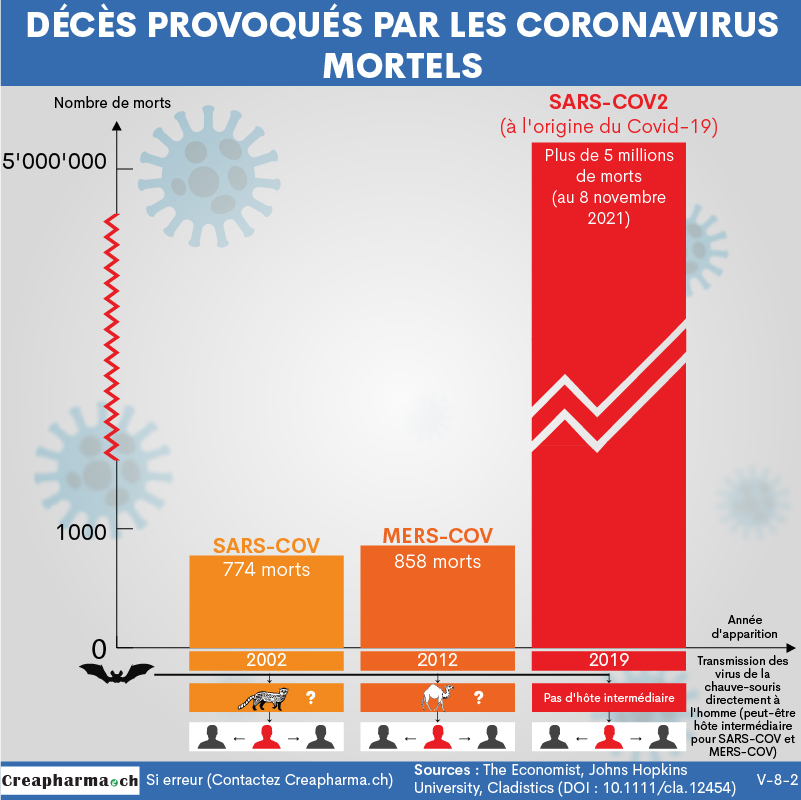
L’immunité cellulaire par les lymphocytes T contre la Covid-19 dure au moins 6 mois, comme le résume un article du magazine anglais The Economist publié en novembre 2020. Ces conclusions proviennent d’une étude non encore publiée, en pre-print, mentionnée par The Economist en novembre 2020. Les scientifiques ont pu montrer que chez 100 personnes infectées par le SARS-CoV-2 toutes avaient 6 mois après l’infection des niveaux détectables de lymphocytes T ciblant le virus SARS-CoV2-. Il est intéressant de noter que pour le virus SARS-CoV-1 (ou SARS-COV) à l’origine du SARS entre 2002 et 2003 des recherches ont montré que certains patients avaient une immunité cellulaire par lymphocytes T durant plus de 10 ans2. On peut donc imaginer sérieusement que l’immunité (cellulaire) contre le SARS-CoV-2 persiste des années.
Diminution normale du taux d’anticorps
Le fait que la concentration des anticorps diminue fortement après quelques mois, comme l’ont montré plusieurs études, n’est pas forcément catastrophique comme on peut parfois le comprendre dans certains médias généralistes. Car tout indique que l’organisme exposé à nouveau au virus a la capacité de produire une nouvelle fois de nombreux anticorps pour détruire ou neutraliser le virus, c’est la mémoire immunitaire (lire davantage ci-dessous). Ce qu’on définit aussi comme immunité adaptative. Comme l’explique la pharmacienne française et ancienne chercheuse à l’INSERM Emma Kahn dans un article publié en octobre 2021, il est normal d’observer une baisse du taux d’anticorps circulants après une infection, c’est ce qui se passe avec toutes les infections, sinon le sang serait épaissi par tous les anticorps qui s’accumuleraient au long de la vie. La pharmacienne précise que parallèlement à cette baisse se construit et s’affine la mémoire immunitaire (lire ci-dessous).
L’immunité innée
L’immunologie est un domaine complexe. Pour simplifier on distingue deux formes d’immunité chez l’être humain, l’immunité innée et l’immunité adaptative. On parle aussi de réponse immunitaire innée et de réponse immunitaire adaptative. Quand un agent infectieux entre dans l’organisme humain comme le SARS-COV-2, c’est tout d’abord l’immunité innée qui se déclenche en quelques minutes ou heures. L’immunité innée est une ligne de défense précoce assurée par des cellules et molécules présentes en permanence et prêtes à éliminer les microbes infectieux comme les virus3. Les mécanismes de l’immunité innée sont variés avec plusieurs cellules et molécules impliquées : phagocytose, dégranulation, interférons, peptides antimicrobiens, etc. Il est intéressant de noter que l’organisme est capable de reconnaître les agents infectieux par des récepteurs (de patern) indiquant sa toxicité pour l’organisme comme par exemple un lipopolysaccharide d’une bactérie puis de déclencher la réponse immunitaire innée notamment par une inflammation. La réponse immunitaire innée n’est pas spécifique comme l’est l’immunité adaptative. La réponse immunitaire innée joue aussi un rôle clé dans l’apparition de la réponse immunitaire adaptative.
L’immunité adaptative (humorale et/ou cellulaire), celle qui nous intéresse
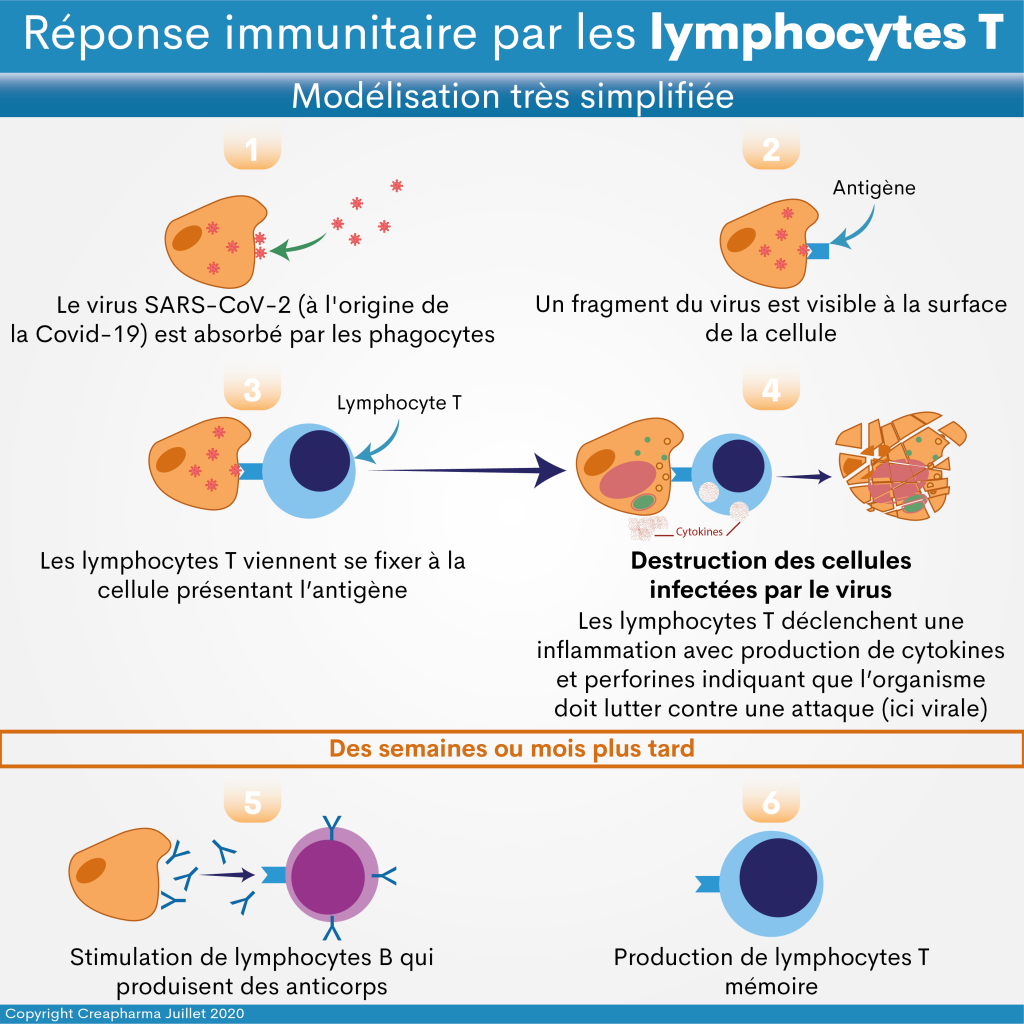
La réponse immunitaire adaptative met plusieurs jours avant de se mettre en place. La réponse immunitaire adaptative mobilise des défenses adaptées spécifiquement à chaque agent pathogène comme ici au virus à l’origine de la Covid-19 (SARS-CoV-2). Ce système est aussi capable de garder une “mémoire” des rencontres précédentes, c’est à la base de la vaccination mais aussi à l’origine de controverses sur la supériorité ou non de l’infection naturelle (immunité acquise naturellement) par rapport à la vaccination, y compris les notions d’ADE (lire ci-dessous). Le système immunitaire adaptatif est constitué principalement de deux types de cellules, les lymphocytes B et les lymphocytes T. L’immunité humorale concerne en général les lymphocytes B et l’immunité cellulaire plutôt les lymphocytes T (ex. TCD8 ou TCD4).
Production d’anticorps, problème de la vaccination ? Etudes israéliennes – Plasmoyctes à longue durée de vie
Les anticorps (antibodies en anglais, parfois aussi qualifiés d’immunoglobulines) sont produits grâce aux lymphocytes B, c’est l’immunité humorale. Les anticorps sont produits dans les lymphocytes B puis exposés sur les cellules, ensuite pour simplifier quand un agent infectieux spécifique se fixe sur l’anticorps, les lymphocytes B vont commencer à se diviser (expansion clonale) puis vont se différencier en plasmocytes, des cellules qui vont produire des anticorps. Ce sont donc les plasmocytes qui produisent en nombre très important les anticorps. Le contournement de l’immunité innée par les vaccins à ARNm pourrait affecter la capacité du système immunitaire à maintenir des niveaux suffisants de plasmocytes à longue durée de vie, comme le relève la pharmacienne Emma Kahn en citant une étude israélienne publiée en pre-print (sans revue par les pairs) en septembre 20214. Une autre étude israélienne, dite observationnelle rétrospective, également publiée en pre-print cette fois en août 20215 est arrivée à la conclusion que l’immunité naturelle confère une protection plus durable et plus forte contre l’infection, la maladie symptomatique et l’hospitalisation causées par le variant Delta du SRAS-CoV-2, par rapport à l’immunité induite par le vaccin à deux doses BNT162b2 (ndlr. vaccin Pfizer).
Anticorps en général
Les anticorps ont plusieurs fonctions, ils peuvent se fixer au virus, puis ce complexe est phagocyté et donc détruit. Les anticorps peuvent aussi simplement neutraliser les agents infectieux (ex. virus). Il faut toutefois noter que les lymphocytes B, pour commencer la production d’anticorps, doivent être activés par les lymphocytes T grâce aux cellules dendritiques, qui sont elles capables de reconnaître un danger. Le danger (le “non soi”) est une condition nécessaire pour activer la réponse immunitaire adaptative à travers les lymphocytes T puis les lymphocytes B.
Anticorps facilitateurs (facilitants, ADE en anglais)
On sait qu’un individu produit des anticorps neutralisant (les bons) et des anticorps facilitant l’infection (les mauvais). Or, tous les vaccins actuels basés sur la protéine Spike du SARS-CoV-2, font produire ces différents types d’anticorps, comme l’explique un article du média français Infodujour.fr qui cite deux scientifiques du CNRS, Jean-Marc Sabatier et Jacques Fantini. Comme le décrit clairement la pharmacienne Emma Kahn le phénomène des anticorps facilitateurs (ou facilitants) est une réponse « inadéquate » à une nouvelle infection par un virus au cours de laquelle les anticorps présents contre ce virus vont aggraver l’infection. En anglais, on parle d’antibody dependent enhancement (ADE). Les vaccins à ARN comme ceux de Pfizer ou Moderna pourraient favoriser l’ADE, comme le souligne une étude publiée en juin 2020 dans Nature (DOI : 10.1038/d41587-020-00016-w), une étude de novembre 2020 publiée également dans Nature (10.1016/j.ijid.2020.09.015) va aussi dans ce sens. Une étude américaine en pre-print (non revue par les pairs, DOI : 10.1101/2021.03.07.21253098) publiée le 1er mai 2021 a montré que la majorité des anticorps induits par le vaccin n’avaient pas d’activité neutralisante sur le virus. Cette étude publiée le 24 mai 2021 dans Cell (DOI : 10.1016/j.cell.2021.05.032) illustre comment un certain anticorps (appelé en anglais Divalent enhancing antibody) peut augmenter l’entrée des virus dans les cellules au niveau des récepteurs ACE2. Une conséquence de l’ADE est que les anticorps contribuent à attirer le virus – si on paraphrase – dans notre système immunitaire, dans les cellules (souvent les macrophages) qui, normalement, devraient combattre le virus et l’empêcher de se répliquer. L’ADE peut donc survenir pour des virus ayant la capacité de se répliquer dans les macrophages tels que les coronavirus6. Dans le cas de l’ADE, le virus a désormais un nouvel environnement pour se répliquer par exemple dans le macrophage et provoque une charge virale beaucoup plus importante et a un impact de la maladie beaucoup plus grand sur l’individu. Au lieu de détruire le virus par neutralisation, le virus peut se multiplier. Le grand média brésilien R7 mentionnait le 11 janvier 2022 une femme de 18 ans en bonne santé morte des complications de la Covid-19 après 2 doses du vaccin Pfizer, il est impossible le 13 janvier 2022 (date de mise à jour de l’article) de savoir les causes exactes du décès. Selon R7, la personne est décédée de thrombose et de pneumonie. Nous n’avons aucune information pour savoir si c’est l’ADE ou non qui est en cause, mais il est important aussi de citer des décès liés à la vaccination et à la maladie, pour montrer que la vaccination n’est pas parfaite.
Dengue
Rappelons qu’en 2017 une campagne de vaccination contre la dengue aux Philippines a été arrêtée à cause de décès provoqués chez des enfants qui n’avaient jamais été en contact avec la dengue. Une explication possible et sérieuse de ces décès est l’ADE. Une vidéo (en anglais) explique bien le mécanisme de l’ADE, avec des illustrations.
Omicron ?
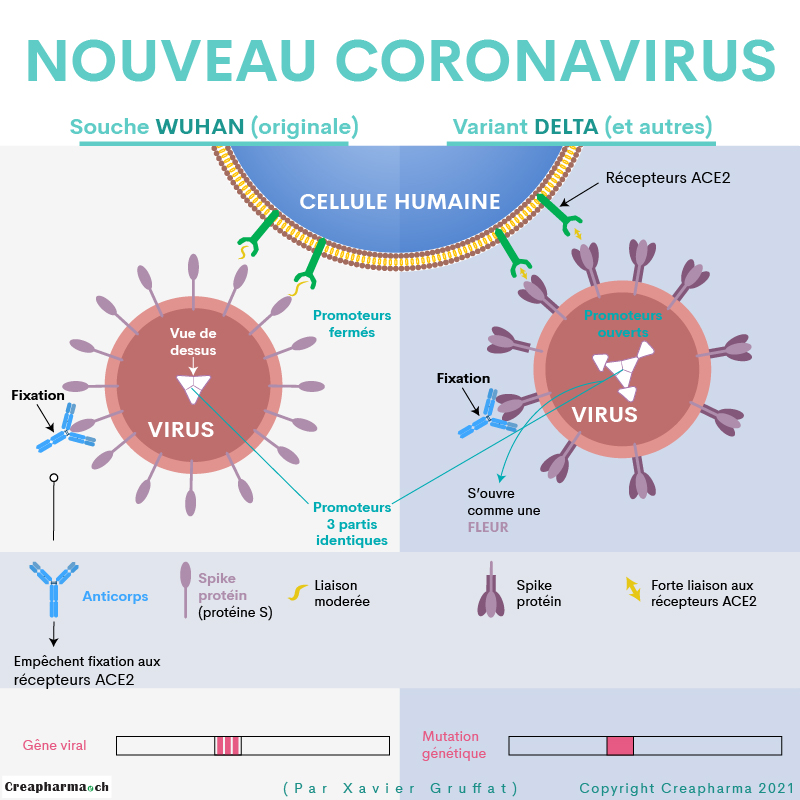
Pour Omicron, le 12 janvier 2022 (date de mise à jour de ce dossier) il était dur d’y voir clair. Certains scientifiques estiment qu’Omicron est presque une autre pandémie, une sorte de SARS-CoV-3 et plus de SARS-CoV-2 à cause des nombreuses mutations notamment sur la protéine S. Une étude publiée le 23 décembre 2021 dans Nature (DOI : 10.1038/d41586-021-03824-59) apporte des preuves supplémentaires de l’évasion immunitaire d’Omicron. Les résultats suggèrent que les personnes précédemment infectées et les personnes entièrement vaccinées sont à risque d’infection par le variant Omicron. Les anticorps des personnes précédemment infectées étaient encore moins susceptibles de neutraliser le variant Omicron que celles vaccinées. Mais une étude anglaise citée par la BBC le 23 décembre 2021 relève que la protection engendrée par un rappel (booster) du vaccin diminue de 15 à 25 % après 10 semaines. On constate clairement que les vaccins ont de la peine à maintenir dans la durée un taux élevé d’anticorps. Certaines personnes pensent qu’Omicron peut favoriser l’ADE. On sait que le SARS-CoV-1 pouvait favoriser l’entrée dans les macrophages, via un mécanisme d’ADE.
Machine de guerre
Il existe dans l’organisme des millions de lymphocytes T dits naïfs (naive ou naïve en anglais) qui circulent prêts à rencontrer l’agent infectieux comme un virus et se dédier par la suite à lutter contre lui. Un lymphocyte T naïf est considéré comme immature et, contrairement aux lymphocytes T activés ou à mémoire, il n’a pas rencontré son antigène apparent dans la périphérie. Ensuite, lorsque les lymphocytes mémoires rencontrent une nouvelle fois l’agent infectieux, ils sont prêts à le détruire. Les lymphocytes T utilisent en fait les cellules tueuses T CD4 et T CD8 pour détruire les cellules infectées par un agent infectieux (ex. virus).
Idée possible
Si on constate que l’immunité chute par exemple 2 à 3 mois après chaque rappel, il pourra peut-être être préférable d’être infecté puis de prendre un médicament comme le Paxlovid™, un antiviral de Pfizer très efficace pour réduire la mortalité en tout cas chez des non vaccinés (l’étude clinique de Pfizer a porté sur des non vaccinés).
Pour aller plus loin, vidéo de mars 2020 (bien au début de la pandémie) en lien avec le gouvernement américain (un Hearings).
Article mis à jour le 14 janvier 2022. Par Xavier Gruffat (pharmacien). Sources : The Economist, autres sources mentionnées dans l’article (études avec no DOI mentionnés dans l’article).
Lire aussi :
– Covid-19 : cas de réinfection mortel au Brésil – Interview exclusif
– Covid-19 : Pourquoi les anticorps générés par le vaccin sont différents de ceux de la maladie ?
Références scientifiques et bibliographie :
- The longitudinal kinetics of antibodies in COVID-19 recovered patients over 14 months, DOI : 10.1101/2021.09.16.21263693 / Comparing SARS-CoV-2 natural immunity to vaccine-induced immunity: reinfections versus breakthrough infections, DOI : 10.1101/2021.08.24.21262415
- Le Bert N, Tan AT, Kunasegaran K, Tham CYL, Hafezi M, Chia A, Chng MHY, Lin M, Tan N, Linster M, Chia WN, Chen MI, Wang LF, Ooi EE, Kalimuddin S, Tambyah PA, Low JG, Tan YJ, Bertoletti A. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature. 2020 Aug;584(7821):457-462. doi: 10.1038/s41586-020-2550-z. Epub 2020 Jul 15. PMID: 32668444.
- Cours de l’EPFL, Suisse : Introduction à l’immunologie: aspects fondamentaux, cours online accédé le 8 août 2020
- The longitudinal kinetics of antibodies in COVID-19 recovered patients over 14 months, DOI : 10.1101/2021.09.16.21263693
- Comparing SARS-CoV-2 natural immunity to vaccine-induced immunity: reinfections versus breakthrough infections, DOI : 10.1101/2021.08.24.21262415
- The “original antigenic sin” and its relevance for SARS-CoV-2 (COVID-19) vaccination, No DOI : 10.1016/j.clicom.2021.10.001, décembre 2021


