Paxlovid, médicament contre la Covid-19
Le Paxlovid est un médicament antiviral en prise orale sous forme de comprimés développé par le laboratoire pharmaceutique américain Pfizer pour traiter la Covid-19, il est disponible dans certains pays sur ordonnance médicale. Il est disponible dans les pharmacies françaises depuis la fin janvier 20221. Selon Pfizer2, le Paxlovid permet de réduire de 88% le risque d’hospitalisation ou de décès par rapport au placebo chez des adultes à haut risque non hospitalisés atteints de la Covid-19, selon les résultats d’essais cliniques. La très célèbre Mayo Clinic (peut-être la plus prestigieuse institution de santé au monde) voit ce médicament de façon favorable même si elle affirme que cela ne doit pas remplacer la vaccination contre la Covid-19. Toutefois, le Paxlovid a un potentiel d’interactions médicamenteuses élevé pouvant être dans certains cas mortelles3 (action sur le cytochrome CYP3A, lire davantage ci-dessous sous Interactions).
Infection par Omicron
Tout indique que le médicament est efficace contre différents variants du virus de la Covid-19 (SARS-CoV-2), y compris Omicron. Comme ce médicament agit sur l’une des protéases virales du SARS-CoV-2 et non sur les protéines de pointes (Spike), des scientifiques, notamment de Pfizer, pensent que le Paxlovid pourrait agir contre différents variants du virus comme Omicron. On sait que les protéines de pointes ont muté ou peuvent muter d’un variant à l’autre mais pas les protéases virales (ou seulement moins de 3 mutations).
Une étude réalisée en Israël publiée le 24 août 2022 dans le journal The New England Journal of Medicine (DOI : 10.1056/NEJMoa2204919) a montré que le Paxlovid réduisait la mortalité de 79% chez des patients âgés de plus de 65 ans infectés en majorité par le variant Omicron du SARS-CoV-2. Cette étude a aussi montré que les taux d’hospitalisation dus au Covid-19 avec le variant Omicron étaient significativement plus faibles chez les personnes ayant reçu du Paxlovid (nirmatrelvir) que chez celles qui n’en ont pas reçu. L’étude a pris en compte des patients en Israël, la majorité vaccinée, entre janvier et mars 2022. Par contre, aucune preuve de bénéfice du Paxlovid n’a été trouvée chez les jeunes adultes.
Recommandations de l’OMS
L’OMS a fortement recommandé le 22 avril 2022 le Paxlovid pour les patients atteints des formes moins sévères du Covid-19 et à plus haut risque d’hospitalisation. Pour les experts de l’OMS, la combinaison nirmatrelvir/ritonavir “est le médicament de choix” pour les patients non vaccinés, âgés ou immunodéprimés, selon un article paru dans le British Journal of Medicine. Le Paxlovid doit être privilégié par rapport au molnupiravir de Merck ou le remdesivir ainsi que les anticorps monoclonaux, précise l’OMS, qui continue toutefois à militer pour la vaccination contre la Covid-19 (en avril 2022).
A base de 2 molécules, 2 antiviraux
Le Paxlovid est une association de 2 molécules, surtout le nirmatrelvir (PF-07321332) qui est un inhibiteur de l’une des protéases virales (appelée 3CL) et le ritonavir à faible concentration qui joue un moindre rôle (comme booster). D’autres inhibiteurs de protéases sont utilisés actuellement pour lutter le VIH ou le virus de l’hépatite C4.
Pfizer avait développé ce médicament déjà en 20025, lors de l’épidémie de SRAS-CoV-1 (ou simplement SARS-CoV). Le SARS-CoV-2 est un virus à ARN simple brin à sens positif, et sa séquence génomique présente une identité d’environ 80% avec celle du SARS-CoV-16. Le laboratoire pharmaceutique s’est aperçu qu’il est également efficace contre le SRAS-CoV-2, virus à l’origine de la Covid-197.
Origine du nom Paxlovid
Le nom Paxlovid viendrait de Pax pour paix (en latin), lo pour love (amours en anglais) et vid pour Covid-19.
Autorisé dans l’UE
Le 27 janvier 2022, l’Agence européenne des médicaments (EMA) a déclaré avoir approuvé l’utilisation en cas d’urgence dans l’Union européenne du Paxlovid. Le Paxlovid est devenu le premier médicament antiviral pris par voie orale autorisé au sein de l’Union européenne.
Le 16 décembre 2021, l’Agence européenne des médicaments (EMA) avait déclaré avoir approuvé l’utilisation en cas d’urgence dans l’Union européenne du Paxlovid8.
Autorisé en France
Le 21 janvier 2022, la Haute autorité de santé (HAS) a autorisé le Paxlovid comme traitement curatif contre la Covid 19.
Autorisé aux Etats-Unis
Le 22 décembre 2021, on a appris que le Paxlovid avait été autorisé par la FDA aux Etats-Unis pour les personnes âgées de 12 ans ou plus à haut risque de Covid-19. Aux Etats-Unis, le médicament est disponible en pharmacie et dans les hôpitaux.
Autorisé en Suisse
En Suisse, on a appris le 15 juin 2022 que le Paxlovid avait été autorisé par Swissmedic (Institut suisse des produits thérapeutiques) pour une durée de 2 ans contre la Covid-19 pour les patients adultes.
Autorisé au Brésil
Le 30 mars 2022, le Brésil a accordé une autorisation d’urgence au Paxlovid (nom du médicament également au Brésil).
Génériques dans de nombreux pays à bas revenu
Pfizer a signé un accord de licence volontaire qui doit permettre de diffuser le Paxlovid – une fois autorisée (c’est déjà le cas dans l’UE, lire ci-dessus) – au-delà des pays riches et combattre plus efficacement une pandémie qui continue de faire des ravages. L’annonce a été faite conjointement le 16 novembre 2021 par Pfizer et la Communauté de brevets sur les médicaments (MPP), créée par Unitaid. Les fabricants de médicaments génériques “qui se voient accorder des sous-licences pourront fournir le nouveau médicament en association avec le ritonavir (un médicament utilisé contre le virus du sida, Ndlr) à 95 pays, couvrant jusqu’à environ 53% de la population mondiale”, a précisé un porte-parole d’Unitaid, Hervé Verhoosen, lors du briefing régulier de l’ONU à Genève.
Noms :
Le nom de marque du médicament est : Paxlovid™ ou PAXLOVID™ (il s’agit d’une marque brevetée appartenant au laboratoire américain Pfizer).
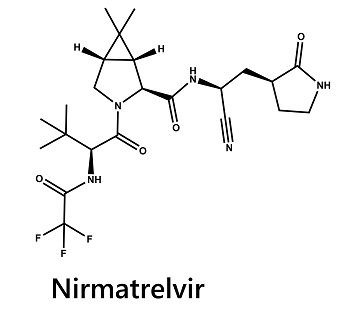
Noms des molécules : 1ère molécule : nirmatrelvir, PF-07321332 (nom de code, voir formule chimique ci-dessous, parfois appelé PF-332). 2ème molécule : ritonavir.
Formules chimiques :
Formule du nirmatrelvir (PF-07321332) : C23H32F3N5O4
Formule du ritonavir : C37H48N6O5S2
Effets – Mécanismes d’action :
Les antiviraux comme le Paxlovid agissent en diminuant la capacité d’un virus à se répliquer, freinant ainsi la maladie.
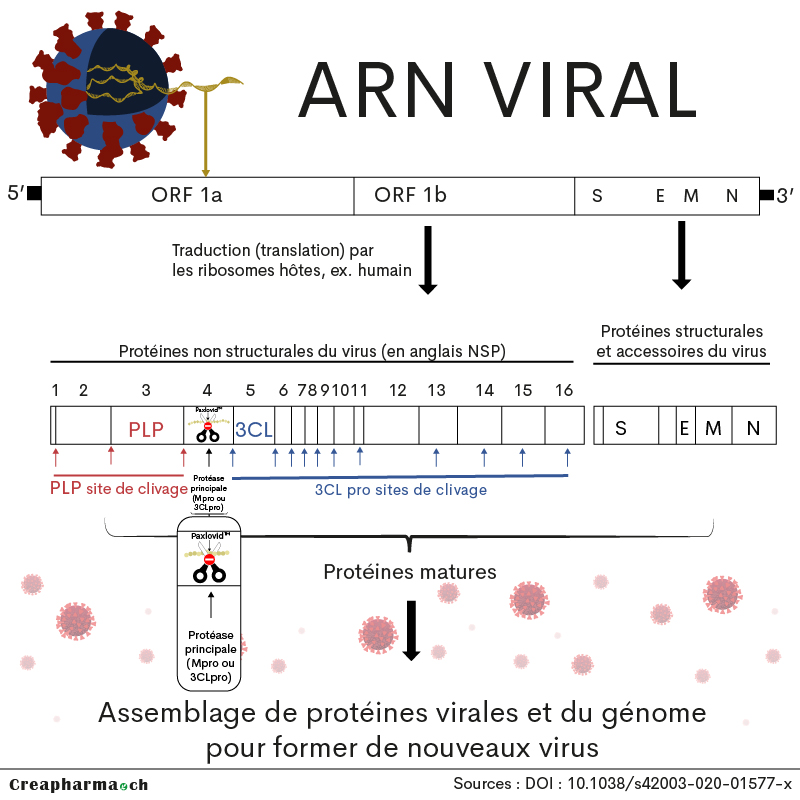
Le SARS-CoV-2, virus à l’origine de la Covid-19, code deux protéases virales à cystéine, la protéase principale (Mpro ou 3CLpro, pour chymotrypsin-like protease) et la protéase de type papaïne (PLpro), qui sont toutes deux des cibles validées de médicaments antiviraux9. La protéase Mpro est une enzyme (protéine) codée par le virus qui est essentielle pour un large éventail de coronavirus, sans analogues humains proches 10. La protéase Mpro est indispensable à la réplication virale11.
Il est important de noter que le Paxlovid agit à l’intérieur des cellules humaines, dans le cytoplasme mais pas dans le noyau cellulaire. Par conséquent, le Paxlovid n’agit pas en dehors de la cellule (ex. au niveau des récepteurs du virus).
Nirmatrelvir
Dans le détail, le nirmatrelvir (PF-07321332) est conçu pour bloquer l’activité de la protéase du SARS-CoV-2-3CL (Mpro). Le nirmatrelvir inhibe la réplication virale à un stade connu sous le nom de protéolyse, qui se produit avant la réplication de l’ARN viral. Dans la cellule humaine, l’ARN viral synthétise des grandes ou longues protéines appelées polypeptides (pp1a et pp1ab)12 qui vont lui permettre de construire le virus, y compris les protéines de structure. Les ribosomes de la cellule humaine permettent notamment la réplication de l’ARN virale. Ces polypeptides doivent être coupés en petite unités pour former les nouveaux virus. Des enzymes appelées protéases (en anglais proteases) sont responsables pour couper ces longs polypeptides. Il faut savoir que ces protéases sont d’origine virale, elles sont donc synthétisées par les gènes du SARS-CoV2 et ne proviennent pas des cellules humaines. Les inhibiteurs des protéases virales comme le nirmatrelvir se fixent sur la protéase pour empêcher (inhiber) son action. Dans les études précliniques, le nirmatrelvir n’a pas démontré d’interactions mutagènes avec l’ADN humaine, comme l’explique le communiqué de presse de Pfizer publié le vendredi 5 novembre 2021. Découvrez ici une vidéo en anglais expliquant bien le mécanisme d’action du Paxlovid au niveau cellulaire
D’autres molécules comme le boceprevir (un inhibiteur de la protéase NS3/4A du virus de l’hépatite C de génotype 1), l’ombitasvir, le paritaprevir (testé contre l’hépatite C), le tipranavir, l’ivermectine et le micafungine ont montré dans une étude publiée début 2021 un effet inhibiteur sur l’activité enzymatique de la protéase Mpro (3CLpro)13.
Ritonavir
L’administration simultanée d’une faible dose de ritonavir aide à ralentir le métabolisme, ou la dégradation, du nirmatrelvir afin qu’il reste actif dans l’organisme pendant de plus longues périodes à des concentrations plus basses pour aider à combattre le virus. Le ritonavir est utilisé en général contre le virus du sida (VIH). Le ritonavir est un inhibiteur du cytochrome CYP3A4. En fait, le CYP3A4 est responsable pour détruire des inhibiteurs de la protéase comme le nirmatrelvir. Grâce au ritonavir, on diminue l’activité du CYP3A4 et par conséquent on augmente la concentration de nirmatrelvir. Ce mécanisme peut toutefois mener à de graves interactions (lire ci-dessous sous Interactions) avec les médicaments également métabolisés par le CYP3A4 comme certaines statines (ex. simvastatine). Découvrez ici une vidéo en anglais expliquant bien le mécanisme d’action du Paxlovid au niveau cellulaire avec l’action du ritonavir
Dans le Paxlovid™, le ritonavir bien qu’il soit à la base un antiviral, n’est pas utilisé comme antiviral14 mais comme aide ou booster pour augmenter l’efficacité du nirmatrelvir.
Indications :
– Covid-19 (en post-exposition, quand les symptômes se sont déjà manifestés). Aux Etats-Unis le médicament est indiqué chez les personnes âgées de 12 ans ou plus et avec un poids de 40 kg ou plus qui sont à haut risque d’évolution vers une maladie grave, y compris l’hospitalisation ou le décès 15.
Le Paxlovid doit être administré dès que possible après le diagnostic de la Covid-19 et dans les 5 jours suivant le début des symptômes 16.
Précision indication en France (état le 21 janvier 2022) :
Le Paxlovid est indiqué pour les adultes atteints de Covid-19 ne nécessitant pas d’oxygénothérapie et à risque élevé d’évolution vers une forme grave de la maladie.
Précision indication dans l’Union Européene (état le 27 janvier 2022) :
Le Paxlovid est indiqué pour le traitement de la Covid-19 chez les adultes qui n’ont pas besoin d’oxygène supplémentaire et qui présentent un risque accru que la maladie devienne grave.
Etude clinique :
Le Paxlovid™ permet de réduire de 88% (au début les études mentionnaient le chiffre de 89% puis par la suite corrigé à 88%) le risque d’hospitalisation ou de décès par rapport au placebo chez des adultes à haut risque non hospitalisés atteints de la Covid-19, selon les premiers résultats d’essais cliniques 17. Dans la population globale de l’étude jusqu’au jour 28, aucun décès n’a été signalé chez les patients ayant reçu le Paxlovid™, contre 10 décès chez les patients ayant reçu le placebo. Ces premiers résultats de Pfizer sont fondés sur des essais cliniques sur un peu plus de 1200 adultes, ayant contracté le Covid-19 et présentant un risque de développer un cas grave de la maladie. Dans les quelques jours suivant l’apparition des symptômes, certains ont reçu la pilule de Pfizer, et d’autres un placebo18. Pfizer a confirmé ces résultats dans un autre communiqué de presse le 14 décembre 2021. Dans ce communiqué de décembre 202119, Pfizer relève qu’après un mois de suivi, l’étude a révélé cinq hospitalisations et aucun décès parmi les 697 personnes ayant reçu le médicament dans les trois premiers jours des symptômes. Parmi les 682 personnes qui ont reçu le placebo, 44 ont été hospitalisées, dont 9 sont décédées. Tous les adultes ayant participé à cette étude n’étaient pas vaccinés.
Les résultats du Paxlovid™ dans l’étude clinique (diminution de 89%, par la suite corrigé à 88%, de la mortalité) étaient si positifs, que Pfizer a décidé avec la FDA américaine d’arrêter de recruter de nouveaux participants. Les laboratoires pharmaceutiques arrêtent en général de recruter de nouveaux participants pour une étude clinique (essai clinique), en accord avec les autorités de santé, si un médicament expérimental s’avère si efficace qu’il ne serait pas éthique de continuer avec des participants recevant un placebo.
Autres études cliniques en cours :
Deux autres essais cliniques sont actuellement menés par l’entreprise. Le premier doit évaluer l’efficacité de la pilule chez une population ne présentant pas de risque accru de développer un cas grave de la maladie. Le deuxième teste la capacité du traitement à réduire à titre préventif les risques d’infection chez l’entourage d’une personne ayant contracté la maladie. Plus d’informations sur les essais cliniques concernant ce médicament : clinicaltrials.gov (site officiel du gouvernement américain)
Etude sur animal, hamsters syriens (très positive) :
Une étude publiée en pre-print (pas encore validé par les pairs) le 5 novembre 2021 sur la plateforme bioRxiv 20 a montré que le PF-07321332 (principale molécule du Paxlovid™) exerce une activité in vitro équipotente contre les quatre variants de préoccupation (VoC) du virus SRAS-CoV-2 et qu’il peut arrêter complètement la réplication du variant alpha dans des cellules épithéliales primaires des voies respiratoires humaines cultivées à l’interface air-liquide. Le traitement de hamsters syriens avec le PF-07321332 (250 mg/kg, deux fois par jour) a complètement protégé les animaux contre une infection intranasale avec les variants bêta (B.1.351) et delta (B.1.617.2) du SRAS-CoV-2.
Etude (en temps réel) en Israël :
Selon des données publiées par la caisse de santé israélienne Maccabi, 92% des patients atteints de la Covid-19 qui ont été traités avec le Paxlovid ont vu leur état considérablement s’améliorer en trois jours, comme l’expliquait i24news le 17 janvier 2022. Maccabi est la deuxième grande caisse maladie d’Israël avec environ 2,5 millions de membres. Jusqu’à présent, 850 d’entre eux ont reçu le médicament Paxlovid.
Posologie :
La posologie dans l’étude clinique pour ceux qui ont reçu le traitement (pas le placebo) était d’une prise 2 fois par jour du Paxlovid™ (nirmatrelvir et faible dose de ritonavir) pendant 5 jours.
Le Paxlovid™ sera administré (une fois enregistré notamment aux Etats-Unis par la FDA) à la dose de 300 mg (deux comprimés de 150 mg) de nirmatrelvir avec un comprimé de 100 mg de ritonavir, en deux prises quotidiennes pendant cinq jours. Cela fait un total de 30 comprimés. Une boîte contient cinq plaquettes alvéolées de Paxlovid, sous forme de comprimés de nirmatrelvir et de comprimés de ritonavir, fournissant toutes les doses requises pour un traitement complet de cinq jours21.
Dans l’étude clinique qui a montré une réduction de la mortalité de 88%, la prise du médicament est effectuée dans les 3 jours après l’apparition des premiers symptômes22.
Troubles de la fonction rénale :
Attention, il faudra faire un ajustement posologique en cas de troubles de la fonction rénale (plus d’informations sur le site suisse de référence Pharmavista.ch).
Effets secondaires :
Selon l’EMA (agence européenne des médicaments), les effets secondaires les plus fréquemment signalés pendant le traitement et jusqu’à 34 jours après la dernière dose de Paxlovid™ étaient la dysgueusie (trouble du goût, avec notamment sensation de goût métallique), la diarrhée et les vomissements. D’autres effets secondaires fréquents étaient l’hypertension et les douleurs musculaires23 ainsi que les vertiges, les problèmes de fois ou de pancréas, les vertiges ou les éruptions cutanées24.
Dans la première analyse des résultats des tests cliniques, le médicament semblait en général sûr et bien toléré25.
Dans l’étude clinique, environ 20% des personnes qui ont reçu le médicament et environ 20% de ceux qui ont reçu le placebo se sont plaints d’effets secondaires26. Le journal canadien La Presse relevait le 26 décembre 2021 que moins de 2% des participants aux études du médicament ont dû arrêter le traitement à cause d’effets secondaires graves (lire liste ci-dessus comme problèmes de foie ou de pancréas, diarrhée, etc.).
Veuillez lire la notice d’emballage du médicament.
Contre-indications :
– Hypersensibilité (allergie)
– Personnes avec une insuffisance hépatique sévère ou une insuffisance rénale sévère27
– Association avec des substances actives dont l’élimination dépend fortement du CYP3A4 (un cytochrome) et si des concentrations élevées entraînent des effets indésirables dangereux ou potentiellement mortels.
– Association avec des inducteurs puissants du CYP3A4 qui entraînent une perte d’efficacité du nirmatrelvir ou du ritonavir.
– Femmes enceintes ou susceptibles de le devenir28.
Veuillez lire la notice d’emballage du médicament.
Interactions :
Le ritonavir est un inhibiteur du cytochrome CYP3A et peut provoquer des interactions médicamenteuses, certaines peuvent être graves voire mortelles. Le nirmatrelvir et le ritonavir sont des substrats du CYP3A. Le médicament présente un potentiel d’interaction élevé. Des interactions potentiellement très graves peuvent survenir avec tous les médicaments métabolisés par le CYP3A comme la simvastatine, une statine couramment utilisée29. La simvastatine peut s’accumuler de façon toxique dans l’organisme, car elle n’est plus éliminée correctement par le CYP3A (le CYP3A4 pour être précis). La FDA liste sur son site des médicaments (molécules) qui ne doivent pas être pris en même temps que le Paxlovid™. D’autres molécules ou médicaments avec un risque grave d’interactions sont notamment (liste non exhaustive) certains neuroleptiques, des analgésiques et le millepertuis.
Veuillez lire la notice d’emballage du médicament. Vous trouverez ici (site Pharmavista.ch) une liste d’interactions (état en juillet 2022).
Forme galénique :
Sous forme de comprimés filmés. On parle parfois aussi en France de “cachet” (langage populaire et pas scientifique), voire de pilule ou de gélule. Mais sur la photo de Pfizer du médicament, on voit clairement qu’il s’agit de comprimés.
Enregistrement du médicament :
Etats-Unis
Le 22 décembre 2021, on a appris que le Paxlovid™ avait été autorisé par la FDA aux Etats-Unis pour les personnes âgées de 12 ans ou plus.
Le 16 novembre 2021, on a appris que Pfizer avait soumis les données à la FDA américaine pour l’autorisation d’utilisation d’urgence (EUA)30.
Union européenne (UE)
Le 16 décembre 2021, l’Agence européenne des médicaments (EMA) a déclaré avoir approuvé l’utilisation en cas d’urgence dans l’Union européenne du Paxlovid™, qui n’a toutefois pas encore reçu une autorisation complète de mise sur le marché.
France
Le 21 janvier 2022, la Haute autorité de santé (HAS) a autorisé le Paxlovid comme traitement curatif contre la Covid 19.
Suisse
En Suisse, on a appris le 15 juin 2022 que le Paxlovid avait été autorisé par Swissmedic (Institut suisse des produits thérapeutiques) pour une durée de 2 ans contre la Covid-19 pour les patients adultes. Pfizer n’a pas fourni de données sur l’efficacité contre le variant Omicron du virus, comme l’a écrit Swissmedic en juin 2022. L’OFSP a annoncé le 20 mai 2022 que la Confédération avait conclu un contrat avec Pfizer pour l’achat de 12’000 emballages de Paxlovid, ce que lui permet l’ordonnance Covid sur les dispositifs médicaux.
Autres pays
Plusieurs autres pays ont enregistré le Paxlovid comme Israël ou le Royaume-Uni (31 décembre 2021). Le Canada a enregistré le médicament le 17 janvier 2022, selon le média de référence La Presse. Le Mexique a aussi enregistré ce médicament à la mi-janvier 2022. Le 12 février 2022 on apprenait que la Chine avait enregistré le Paxlovid “sous condition”, uniquement pour les patients risquant de développer une forme grave de la Covid-1931.
Production annuelle, utilisation et commande des états :
En 2022, Pfizer devrait produire un traitement complet pour 120 millions de personnes, selon un article du Wall Street Journal du 22 décembre 2021.
D’ici fin 2021, Pfizer prévoit de livrer un traitement complet pour environ 180’000 personnes notamment aux Etats-Unis, selon Reuters.
Etats-Unis
Le 18 novembre 2021 on a appris que le gouvernement américain avait commandé les gélules du Paxlovid™ pour traiter 10 millions de personnes, à un coût total de 5,29 milliards de dollars. Cela revient à un coût de traitement par personne de 529 dollars32. Mais le 5 janvier 2022, CNN relève que Joe Biden aurait demandé à son équipe de commander au total ce traitement pour 20 millions de personnes et plus 10 millions.
En avril 2022, on apprenait au total que 500’000 traitements complets de Paxlovid ont été administrés aux Etats-Unis33. L’administration (gouvernement) Biden a annoncé le 26 avril 2022 une série d’initiatives visant à accroître l’utilisation de pilules antivirales pour traiter la Covid-19, avec un accent particulier sur le Paxlovid, selon plusieurs médias comme la TV CNN.
Remarques :
– Le Paxlovid n’a pas été réadapté (en anglais Drug repurposing) à partir d’un autre médicament, mais développé spécifiquement contre le SARS-CoV-2. Comme on l’a vu au début de ce dossier Pfizer avait déjà développé ce médicament en 200234, lors de la première épidémie de SRAS-CoV.
– En se basant sur les études cliniques à disposition (divulguées par des communiqués de presse) en novembre et décembre 2021, le Paxlovid a des résultats supérieurs autant contre le risque d’hospitalisation et la mort chez des patients atteints de la Covid-19 que le molnupiravir, un autre antiviral utilisé en prise orale (en gélule)35.
– Le principe actif principal du médicament (nirmatrelvir) sera produit à Mourenx, dans les Pyrénées-Atlantiques, via un accord avec le français Novasep, comme l’expliquait plusieurs médias le 17 janvier 2022 comme Le Figaro ou BFMTV.
Ventes (chiffre d’affaires) globales gigantesques :
– Selon la banque JPMorgan Chase & Co. analysts, citée par le WSJ du 22 décembre 2021, le Paxlovid™ pourrait mener à un chiffre d’affaires de 18 milliards de dollars pendant l’année 2022. D’autres médias comme le New York Times parlent même d’un chiffre d’affaires de plus de 30 milliards de dollars en 2022. On parle d’un méga blockbuster dans la jargon de l’industrie pharmaceutique.
Alternatives (inhibiteurs de protéase) :
Le camostat est une molécule appartenant aussi inhibiteurs de protéase agissant contre le SARS-CoV-2. Le camostat est approuvé au Japon sous forme de comprimés (Foipan®), mais pas en Suisse36. Dans le détail, le camostat est un inhibiteur de la protéase à sérine. Le camostat est utilisé, entre autres, pour l’inflammation du pancréas et l’œsophagite par reflux postopératoire. Il n’est pas clairement indiqué (on-label) contre la Covid-19, mais plutôt hors indication officielle (off-label).

News :
– Covid-19 : une étude montre l’excellente efficacité du Paxlovid™ (mars 2023)
Lire la notice d’emballage pour patients du Paxlovid™ en Suisse
Sources & Références :
Sources :
The Wall Street Journal, communiqué de presse de Pfizer, AFP, Pharmawiki.ch, Keystone-ATS, Reuters, Folha de S.Paulo, CNN, Mayo Clinic (article du 22 décembre 2021), France Info, Le Figaro, OMS, STAT News.
Etudes :
International Journal of Molecular Sciences (DOI : 10.3390/ijms22179124), Science (DOI : 10.1126/science.abl4784), Protein & Cell (DOI : 10.1007/s13238-021-00883-2), Journal of Molecular Graphics & Modelling (DOI : 10.1016/j.jmgm.2021.108042), The New England Journal of Medicine (DOI : 10.1056/NEJMoa2204919).
Etude (pre-print) :
Via bioRxiv (étude du 5 novembre 2021, DOI : 10.1101/2021.11.04.467077).
Décharge juridique : les lecteurs de cette page sont invités à vérifier toute information contenue dans ce site (ici dans cette page) avant d’entreprendre toute action sur la base de cette information.
Rédaction :
Xavier Gruffat (Pharmacien)
Dernière mise à jour :
16.03.2023
Crédits photos :
Adobe Stock, Creapharma.ch – Ce médicament en portugais : Paxlovid™
Infographie : Pharmanetis Sàrl (Creapharma.ch)
Références scientifiques et bibliographie :
- Le Figaro, Covid-19 : ce qu’il faut savoir sur Paxlovid, la pilule de Pfizer bientôt distribuée en France, 17 janvier 2022
- PFIZER’S NOVEL COVID-19 ORAL ANTIVIRAL TREATMENT CANDIDATE REDUCED RISK OF HOSPITALIZATION OR DEATH BY 89% IN INTERIM ANALYSIS OF PHASE 2/3 EPIC-HR STUDY, 5 novembre 2021, le lien marchait à cette date et PFIZER ANNOUNCES ADDITIONAL PHASE 2/3 STUDY RESULTS CONFIRMING ROBUST EFFICACY OF NOVEL COVID-19 ORAL ANTIVIRAL TREATMENT CANDIDATE IN REDUCING RISK OF HOSPITALIZATION OR DEATH, 14 décembre 2021
- The Wall Street Journal, édition du 1er janvier 2022
- Folha de S.Paulo, édition du 15 décembre 2021, version papier, article basé sur l’agence de presse Reuters
- Dans le détail le PF-07321332 ou nirmatrelvir a été développé par modification d’un candidat clinique antérieur, le PF-07304814. Le PF-07304814 doit être administré par voie intraveineuse, ce qui limite son utilisation au milieu hospitalier
- Crystal structure of SARS-CoV-2 main protease in complex with protease inhibitor PF-07321332, 22 octobre 2021, DOI : 10.1007/s13238-021-00883-2
- Etude en pre-print sur BioRxiv, datant du 5 novembre 2021, document PDF, The oral protease inhibitor (PF-07321332) protects Syrian hamsters against infection with SARS-CoV-2 variants of concern, DOI : 10.1101/2021.11.04.467077
- EMA issues advice on use of Paxlovid (PF-07321332 and ritonavir) for the treatment of COVID-19, 16 décembre 2021
- Validation and invalidation of SARS-CoV-2 papain-like protease inhibitors (DOI : 10.1101/2021.11.04.467342), le 5 novembre 2021, étude en Pre-Print
- Discovery of a Novel Inhibitor of Coronavirus 3CL Protease for the Potential Treatment of COVID-19 (DOI : 10.1101/2020.09.12.293498), le 12 février 2021, étude en Pre-Print
- Communications Biology, le 20 janvier 2021, DOI : 10.1038/s42003-020-01577-x
- Journal Science, 2 novembre 2021 (DOI : 10.1126/science.abl4784)
- Communications Biology, le 20 janvier 2021, DOI : 10.1038/s42003-020-01577-x
- “The Medical Letter on Drugs and Therapeutics“, Etat de New York, Etats-Unis, article du 24 janvier 2022 consacré au Paxlovid (Paxlovid for Treatment of COVID-19)
- “The Medical Letter on Drugs and Therapeutics“, Etat de New York, Etats-Unis, article du 24 janvier 2022 consacré au Paxlovid (Paxlovid for Treatment of COVID-19)
- EMA issues advice on use of Paxlovid (PF-07321332 and ritonavir) for the treatment of COVID-19, 16 décembre 2021
- PFIZER’S NOVEL COVID-19 ORAL ANTIVIRAL TREATMENT CANDIDATE REDUCED RISK OF HOSPITALIZATION OR DEATH BY 89% IN INTERIM ANALYSIS OF PHASE 2/3 EPIC-HR STUDY, 5 novembre 2021, le lien marchait à cette date et The Wall Street Journal du 1er janvier 2022
- Covid-19 : la pilule anti-Covid de Pfizer efficace à 89% contre les hospitalisations et décès, Le Figaro et AFP, article du 5 novembre 2021
- PFIZER ANNOUNCES ADDITIONAL PHASE 2/3 STUDY RESULTS CONFIRMING ROBUST EFFICACY OF NOVEL COVID-19 ORAL ANTIVIRAL TREATMENT CANDIDATE IN REDUCING RISK OF HOSPITALIZATION OR DEATH, 14 décembre 2021
- The oral protease inhibitor (PF-07321332) protects Syrian hamsters against infection with SARS-CoV-2 variants of concern, DOI : 10.1101/2021.11.04.467077
- PFIZER ANNOUNCES ADDITIONAL PHASE 2/3 STUDY RESULTS CONFIRMING ROBUST EFFICACY OF NOVEL COVID-19 ORAL ANTIVIRAL TREATMENT CANDIDATE IN REDUCING RISK OF HOSPITALIZATION OR DEATH, 14 décembre 2021
- The Wall Street Journal, via App payante du journal, le 16 novembre 2021
- Site en allemand Pharmawiki.ch, article consacré au nirmatrelvir, accédé par Creapharma.ch le 26 décembre 2021
- La Presse (média canadien), le 26 décembre 2021
- The Wall Street Journal, via App payante du journal, le 5 novembre 2021, le journal citant des informations du laboratoire Pfizer
- Agence de presse Reuters, via le journal brésilien de référence Folha de S.Paulo datant du 6 novembre 2021
- Le Figaro, Covid-19 : la Haute autorité de santé autorise le traitement antiviral Paxlovid de Pfizer, le 21 janvier 2022
- Journal canadien La Presse, édition du 26 décembre 2021
- The Wall Street Journal, 1er janvier 2022
- The Wall Street Journal, via App, le 16 novembre 2021
- Agence de presse suisse Keystone-ATS, avec notre partenaire Pharmapro.ch qui est client de l’agence. Le 12 février 2022
- The Wall Street Journal, via App, le 18 novembre 2021
- STAT News, article du 26 avril 2022 sur le Paxlovid
- Dans le détail le PF-07321332 ou nirmatrelvir a été développé par modification d’un candidat clinique antérieur, le PF-07304814. Le PF-07304814 doit être administré par voie intraveineuse, ce qui limite son utilisation au milieu hospitalier
- Agence de presse Reuters, via le journal brésilien de référence Folha de S.Paulo datant du 6 novembre 2021
- Site en allemand Pharmawiki.ch


