Molnupiravir (Lagevrio)
Résumé :
Le molnupiravir est une molécule (médicament) antivirale indiquée contre la Covid-19, en postexposition, en particulier au début de l’apparition des symptômes. Le molnupiravir réduit d’environ 30% (dans un premier temps le laboratoire parlait de 50%) le risque d’hospitalisation, selon une étude clinique du laboratoire MSD. Ce médicament est disponible sur le marché depuis le 4 novembre 2021 au Royaume-Uni ainsi que dans l’Union Européenne depuis le 19 novembre 2021 et aux Etats-Unis depuis le 23 décembre 2021, selon nos informations il n’est pas encore disponible en Suisse. La prise rapidement du médicament après les symptômes a obtenu de bons résultats lors de l’essai clinique (lire davantage ci-dessous). Le molnupiravir est le premier produit de ce type à être mis sur le marché pour traiter la Covid-19, ce qui, après les vaccins, représente une avancée majeure dans la lutte contre la pandémie1. Plusieurs pays comme les Etats-Unis et l’Union Européenne ont autorisé en décembre 2021 le Paxlovid™, également un médicament en prise orale et qui s’avère plus efficace que le molnupiravir. Le molnupiravir est aussi efficace contre les variants du virus SARS-CoV-2, comme le variant Delta et probablement Omicron (lire paragraphe ci-dessous). Le molnupiravir ne doit pas être utilisé chez la femme enceinte (liste non exhaustive de contre-indications, lire ci-dessous et surtout la notice d’emballage du médicament).
Omicron
Le molnupiravir reste “active” contre le variant Omicron, a déclaré le 28 janvier 2022 l’entreprise américaine, en se fondant sur les résultats de six études réalisées en laboratoire. Ces études in vitro, réalisées à partir d’essais sur des cellules, ont été réalisées de façon indépendante par des chercheurs dans six pays (Belgique, Allemagne, République tchèque, Pologne, Pays-Bas et Etats-Unis). Selon le fabricant, le molnupiravir, sur la base de son mécanisme d’action, devrait également être efficace contre le variant Omicron2.
Noms :
Molnupiravir, Molnupiravirum, EIDD-2801, MK-4482, Lagevrio (nom de marque au Royaume-Uni ou en France).
Formule chimique :
C13H19N3O7
Effets :
Les antiviraux comme le molnupiravir agissent en diminuant la capacité d’un virus à se répliquer, freinant ainsi la maladie. Le molnupiravir est un agent antiviral appartenant au groupe des inhibiteurs de l’ARN polymérase (voir infographie ci-dessous). Le molnupiravir est un promédicament (pro-drug) de petite molécule du dérivé nucléosidique synthétique N-hydroxycytidine (NHC)3. Comme l’explique le site Pharmawiki.ch le molnupiravir est rapidement biotransformé dans le plasma en EIDD-1931. Ce dernier est triphosphorylé par les kinases de l’organisme. Ce triphosphate (complexe triphosphate et EIDD-1931) est l’ingrédient actif. Il agit comme un faux substrat pour l’ARN polymérase virale, c’est un leurre. Bref, le molnupiravir cible l’ARN polymérase virale.
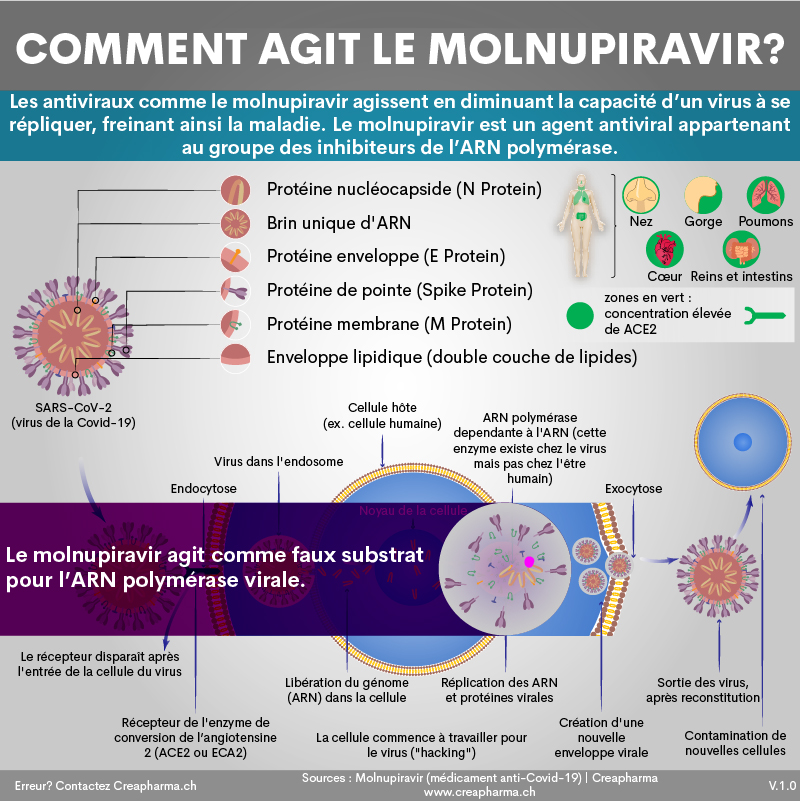
Indications :
– Covid-19 (lire ci-dessous). En postexposition de la maladie, c’est-à-dire après les premiers symptômes de la Covid-19, à la différence de la vaccination qui agit en préexposition.
Remarques :
– Comme le médicament n’agit par sur la protéine de pointe (Spike) comme certains vaccins, on estime que ce médicament peut agir contre différents variants du SARS-CoV-2.
– Au Royaume-Uni, le molnupiravir est indiqué pour les adultes à haut risque atteints de Covid-19 avec des symptômes légers à modérés (en anglais : High-risk adults with mild to moderate disease)4.
– Le 10 décembre 2021, on a appris que la Haute Autorité de santé (HAS) « n’autorise pas l’accès précoce » du monulpiravir aux patients en France en « traitement curatif des formes légères et modérées de la Covid-19 ». Selon la HAS, “les résultats d’efficacité avancés par le laboratoire sont moins bons que ceux des traitements disponibles”. Ils ne réduiraient que de 30% les risques de progression de la maladie vers une forme grave, alors que certains anticorps monoclonaux sont efficaces à 80%.
Etude (réduction de 30% de l’hospitalisation et possible très forte réduction de la mortalité) :
Merck (MSD hors Etats-Unis et Canada) a rendu publics le 26 novembre 2021 les résultats complets de l’essai clinique du molnupiravir, selon lesquels le médicament le médicament réduirait de 30% – bien en deçà du chiffre initial – le taux d’hospitalisation et de décès chez les patients à risque l’ayant pris peu après avoir été infectés.
En effet, dans un premier temps Merck avait affirmé que le molnupiravir était capable de réduire le risque d’hospitalisation et de mort de 50% chez des patients souffrant de Covid-19 léger ou modéré lors de prise rapidement après les symptômes, selon le Wall Street Journal du 1er octobre 2021 et du 4 novembre 2021, citant notamment un communiqué de presse du laboratoire. Le médicament était si efficace que le laboratoire américain Merck (appelé MSD hors des Etats-Unis et Canada), ainsi que Ridgeback Biotherapeutics qui a participé au développement de ce médicament, ont arrêté de recruter de nouveaux participants dans leur essai clinique final en accord avec la FDA (agence américaine des médicaments). Le 26 novembre 2021 on a appris que selon les résultats complets, le taux d’hospitalisation chez les patients ayant reçu le médicament a été de 6,8%, contre 9,7% chez ceux ayant eu un placebo. Un décès a été constaté chez les personnes traitées avec le molnupiravir, contre 9 dans le deuxième groupe.
Effets secondaires :
Les effets secondaires les plus fréquents (pouvant toucher jusqu’à 1 personne sur 10) sont : diarrhée, nausées, sensation de vertige et maux de tête. Des effets secondaires peu fréquents (pouvant toucher jusqu’à 1 personne sur 100) sont : vomissements, éruption cutanée et urticaire 5.
Etude sur les effets secondaires :
Dans la partie finale de l’étude (late-stage study), le molnupiravir a été testé chez des personnes non vaccinées. Le taux d’effets secondaires pour les participants ayant reçu le médicament et ceux ayant reçu le placebo étaient similaires, selon les deux entreprises (MSD et Ridgeback Biotherapeutics).
Contre-indications :
Le molnupiravir ne doit pas être utilisée par les femmes enceintes (grossesse) ou les femmes qui n’utilisent pas de contraception et pourraient tomber enceintes, a précisé l’EMA6. “Ces recommandations sont données car des études de laboratoire sur des animaux ont montré que des doses élevées de (la pilule Merck, c’est-à-dire molnupiravir) peuvent avoir un impact sur la croissance et le développement du foetus”, a-t-il ajouté. La FDA a proposé fin novembre 2021 au comité de ne pas recommander l’autorisation du molnupiravir chez les femmes enceintes, estimant qu'”il n’existe aucun scénario clinique où les bénéfices l’emportent sur les risques” au sein de cette population. Si aucune femme enceinte n’était incluse dans l’essai clinique de Merck, la FDA base sa recommandation sur les résultats de l’étude sur des rats et lapins en gestation, dont certaines portées ont connu plus de cas de malformation qu’au sein des groupes de contrôle.
Interactions :
Aucune interaction médicamenteuse cliniquement significative avec le molnupiravir n’a été identifiée7.
Forme galénique :
Le molnupiravir est vendu sous forme orale, en gélule (pilule ou pill en anglais). Il peut donc être pris à la maison ou à l’hôpital. Au Royaume-Uni, il est vendu sous forme de capsules dures contenant 200 mg de molnupiravir, sous le nom de marque de Lagevrio8.
Posologie molnupiravir :
Posologie au Royaume-Uni (état le 4 novembre 2021, veuillez toujours lire la notice d’emballage) :
La durée du traitement contre la Covid-19 consiste à prendre 40 gélules (pilules) sur une durée de 5 jours, à raison de 8 gélules par jour en 2 prises9, cela signifie quatre gélules de 200 mg toutes les 12 heures pendant 5 jours10.
Il faut commencer la thérapie de molnupiravir dans les 5 jours après l’apparition des premiers symptômes. Autrement dit, il n’est pas conseillé de commencer la thérapie au 6ème jour (ou après) les premiers symptômes, car l’efficacité est diminuée11.
Remarques sur la prise des gélules :
– Avalez chaque gélule entière avec beaucoup de liquide (par exemple un verre d’eau).
– Ne pas ouvrir, casser ou écraser les gélules.
– Ce médicament peut être pris avec ou sans nourriture.
Mises sur le marché et commandes:
Le traitement, parfois commercialisé sous le nom de Lagevrio, a été autorisé dans plus de dix pays (état : fin janvier 2022), dont les Etats-Unis, le Royaume-Uni et le Japon.
Royaume-Uni :
L’agence britannique de sécurité des médicaments et produits de santé (MHRA) a approuvé le jeudi 4 novembre 2021 la mise sur son marché du molnupiravir contre la Covid-1912. Le Royaume-Uni est le premier pays au monde à avoir enregistré ce médicament.
Le Royaume-Uni avait commandé ou garanti en octobre 2021 un total de 480’000 traitements complets de molnupiravir pour sa population, selon la BBC il devrait être disponible à la mi-novembre 2021.
Union Européenne (UE) :
L’Agence européenne des médicaments (EMA), basé à Amsterdam, a déclaré le 19 novembre 2021 avoir approuvé l’utilisation en cas d’urgence dans l’Union européenne du molnupiravir, qui n’a toutefois pas encore reçu une autorisation complète de mise sur le marché.
Les Etats membres de l’UE peuvent depuis le 19 novembre 2021 utiliser le molnupiravir “pour traiter les adultes atteints de la Covid-19 qui n’ont pas besoin d’oxygène supplémentaire et qui présentent un risque accru de développer une forme sévère” de la maladie, a annoncé l’EMA dans un communiqué.
Le régulateur (EMA) estimait dans un communiqué en date du 19 novembre 2021 espérer se prononcer sur l’autorisation formelle du molnupiravir d’ici la fin de l’année 2021.
France :
Le 10 décembre 2021 on a appris que la Haute Autorité de santé (HAS) « n’autorise pas l’accès précoce » du monulpiravir aux patients en France en « traitement curatif des formes légères et modérées de la Covid-19 ». Pourtant le 25 novembre 2021, le Ministre de la Santé Olivier Véran avait annoncé que le molnupiravir serait disponible en pharmacie dès décembre 2021.
Etats-Unis :
Le 23 décembre 2021, les Etats-Unis ont autorisé, via leur agence FDA, le molnupiravir contre la Covid-19. Le molnupiravir est indiqué chez des adultes (18 ans ou plus) à haut risque, la prise doit être faite les heures ou jours après l’apparition de symptômes légers à modérés de la Covid-19. La FDA recommande toutefois d’utiliser le molnupiravir seulement si d’autres médicaments ne sont pas disponibles et médicalement utiles contre la Covid-1913.
Demandes de mise sur le marché :
Suisse :
En Suisse, une demande d’autorisation temporaire de mise sur le marché a été déposée par MSD auprès de Swissmedic le 16 août 202114.
La Suisse a conclu un contrat avec l’entreprise MSD Merck Sharp & Dohme (MSD) Suisse pour la réservation du molnupiravir. Ce contrat porte sur un contrat portant sur un maximum de 8640 emballages de l’antiviral15. Le molnupiravir devrait être disponible au plus tard en janvier 2022, indiquait le 23 novembre 2021 l’Office fédéral de la santé publique (OFSP). Le montant du contrat entre la Confédération suisse et MSD est confidentiel.
Etude de phase 3 :
Même si le molnupiravir est déjà commercialisé au Royaume-Uni ou dans l’UE il continue à être étudié dans des études cliniques dites de phase 3. Aux Etats-Unis, l’hôpital Montefiore-Einstein basé à New York est notamment responsable de cette étude clinique en phase finale16. Au Brésil, c’est notamment l’institution Fiocruz (Fundação Osvaldo Cruz) à Rio de Janeiro qui participe à cette étude de phase 317. Cette étude (phase 3) randomisée, en double aveugle et contrôlée par placebo sur le molnupiravir porte sur environ 1’300 personnes réparties sur 114 sites dans le monde. Tous les participants à cette étude doivent être âgés de 18 ans ou plus, être totalement non vaccinés, ne présenter aucun symptôme de Covid-19 et partager un foyer avec une personne connue pour avoir été testée positive au Covid-19 dans les 5 jours précédents.
Remarques :
– Le molnupiravir a été mis au point à l’Université Emory à Atlanta (Géorgie) aux Etats-Unis. A l’origine, la molécule était développée contre la grippe.
– Un traitement devrait coûter en Europe dans les 600 euros.
– L’application d’un antiviral comme le molnupiravir peut être double : à la fois permettre aux personnes déjà atteintes de ne pas souffrir de symptômes graves, mais aussi à celles ayant été en contact rapproché de ne pas développer la maladie.
– Si le Paxlovid est disponible, il doit généralement être essayé en premier sauf exception médicale (ex. risque élevé d’interactions médicamenteuses avec le Paxlovid). On sait que le Paxlovid a une efficacité supérieure contre la mort que le molnupiravir, selon les études cliniques de phase 3.
Sources & Références :
Sources :
BBC, Site du gouvernement britannique, AFP, Keystone-ATS (plusieurs dépêches), The Wall Street Journal, Pharmawiki.ch, Folha de S.Paulo. Lire aussi les notes de bas de page tout en bas de la page.
Rédaction :
Xavier Gruffat (Pharmacien). Relecture (Seheno Harinjato, rédactrice chez Creapharma.ch).
Dernière mise à jour :
28.01.2022
Crédits photos :
Fotolia.com/Adobe Stock – Cette page en portugais : Molnupiravir
Références scientifiques et bibliographie :
- AFP, dépêche du 1er octobre 2021
- “The Medical Letter on Drugs and Therapeutics“, Etat de New York, Etats-Unis, article du 24 janvier 2022 (Molnupiravir for Treatment of COVID-19) consacré au molnupiravir
- “The Medical Letter on Drugs and Therapeutics“, Etat de New York, Etats-Unis, article du 24 janvier 2022 (Molnupiravir for Treatment of COVID-19) consacré au molnupiravir
- The Wall Street Journal online, le 4 novembre 2021
- Patient Information Leaflet for Lagevrio, le 4 novembre 2021, le lien marchait à cette date
- Agence de presse suisse Keystone-ATS, avec notre partenaire Pharmapro.ch qui est client de l’agence. Le 19 novembre 2021
- “The Medical Letter on Drugs and Therapeutics“, Etat de New York, Etats-Unis, article du 24 janvier 2022 (Molnupiravir for Treatment of COVID-19) consacré au molnupiravir
- Patient Information Leaflet for Lagevrio, le 4 novembre 2021, le lien marchait à cette date
- The Wall Street Journal online, le 4 novembre 2021
- Patient Information Leaflet for Lagevrio, le 4 novembre 2021, le lien marchait à cette date
- Article du site BBC, First pill to treat Covid gets approval in UK, en date du 4 novembre 2021, accédé à la même date par Creapharma et le lien marchait
- Keystone-ATS, dépêche du 4 novembre 2021 et article online du Wall Street Journal du 4 novembre 2021
- The Wall Street Journal, 23.12.2021
- Pharmavista.ch, article du 5 octobre 2021
- Agence de presse suisse Keystone-ATS, avec notre partenaire Pharmapro.ch qui est client de l’agence. Le 23 novembre 2021
- Montefiore-Einstein researchers test whether Molnupiravir can prevent COVID-19, via Eurekalert, le 4 novembre 2021
- Site R7.com – article du 4 novembre 2021, accédé le 5 novembre 2021

