Vaccins contre la Covid-19
Article mis à jour le 7 novembre 2021 – Les sources sont mentionnées surtout en bas de l’article
Question intéressante : Puis-je me faire vacciner le même jour contre la Covid-19 que la grippe ?
Etat de la vaccination et phases de développement
Etat de la vaccination
– Le site du Milken Institute, basé en Californie, résume de façon presque hebdomadaire l’avancée des vaccins et projets de vaccin dans le monde contre la Covid-19. Le Milken Institute estimait le 29 octobre 2021 qu’il y avait 272 vaccins ou projets de vaccin en développement dans le monde contre la Covid-19 avec 104 vaccins en phase clinique et 22 autorisés (en anglais, in use, c’est-à-dire mis sur le marché dans certains pays, lire ci-dessous pour découvrir les vaccins commercialisés).
Phases de développement d’un vaccin
Il existe 5 phases de développement d’un vaccin (6 si on inclut la phase d’enregistrement du vaccin appelée RR). Toutes ces phases prennent plusieurs années, mais avec la Covid-19 pour des raisons évidentes toutes les phases sont beaucoup plus rapides.
– La phase pré-clinique avec notamment la collecte de données pour étayer la faisabilité et la sécurité ainsi qu’évaluer les effets toxiques et pharmacologiques.
– La phase clinique 1 (ou I) réalisée sur des dizaines de personnes en bonne santé pour vérifier la sécurité et d’éventuels effets secondaires.
– La phase clinique 2 (ou II) est réalisée sur des centaines de personnes, cette phase permet d’évalue la sécurité, l’efficacité et déterminer la dose optimale ainsi que le calendrier de vaccination.
– La phase clinique 3 (ou III) réalisée cette fois sur des milliers ou dizaines de milliers de personnes, afin d’évaluer davantage la sécurité et l’efficacité du vaccin.
– Parfois on parle après la phase 3 de la phase Regulatory Review (RR), à ce moment une agence de santé comme la FDA (Etats-Unis) examine les données des essais cliniques et les informations relatives aux demandes de licence avant l’approbation (peut se produire alors que la fabrication a commencé).
– Finalement la phase clinique 4 (ou IV) se base sur des études post-approbation du vaccin qui contrôlent l’efficacité dans des conditions réelles avec des millions de personnes prises en compte. A ce moment, le vaccin est déjà disponible sur le marché.
Efficacité nécessaire minimum du vaccin et nombre de personnes à vacciner
Efficacité minimum d’un vaccin contre la Covid-19
– Un vaccin contre la Covid-19 devra ou doit avoir une efficacité de 50%, pour qu’il soit recommandé par l’OMS, comme l’a expliqué l’organisation basée à Genève le 31 août 2020.
– Un autre point important est la preuve que le vaccin soit sûr, cela signifie que les éventuels effets secondaires doivent être rare.
– Selon la FDA, agence de régulation des médicaments, un vaccin devrait ou doit avoir une efficacité d’au moins 50% pour être approuvé. Cela signifie que 50% des personnes vaccinées ne devraient pas souffrir de Covid-19.
– Les vaccins à ARN (ex. de Pfizer/BioNTech et de Moderna), mis sur le marché en décembre 2020, ont une efficacité supérieure à 90%.
Combien de personnes doivent être vaccinées pour stopper le virus ?
Il faudra vacciner au moins 80% de la population si la souche B.1.1.7 (dite souche anglaise ou britannique) circule de façon majoritaire, ce qui pourrait être le cas en mars 2021 aux Etats-Unis. Selon un article du Wall Street Journal datant du 16 janvier 2021, à cause de la nouvelle variante du Coronavirus (“anglaise”) appelée B.1.1.7 environ 80% de la population devra être vaccinée pour stopper le virus, contre 70% avec la variante “normale” ou non B.1.1.7. C’est donc environ 10% de plus de personnes à vacciner que ce qui avait été annoncé par le passé par des fonctionnaires fédéraux, toujours selon le WSJ.
Conseil pratique vaccin :
Aux Etats-Unis, les CDC (Centres pour le contrôle et la prévention des maladies) estiment que les personnes doivent être surveillées pendant 15 minutes après avoir reçu une injection d’un vaccin contre la Covid-19, et 30 minutes si elles ont des antécédents d’allergies graves.
Vaccins mis sur le marché et en phase clinique 3
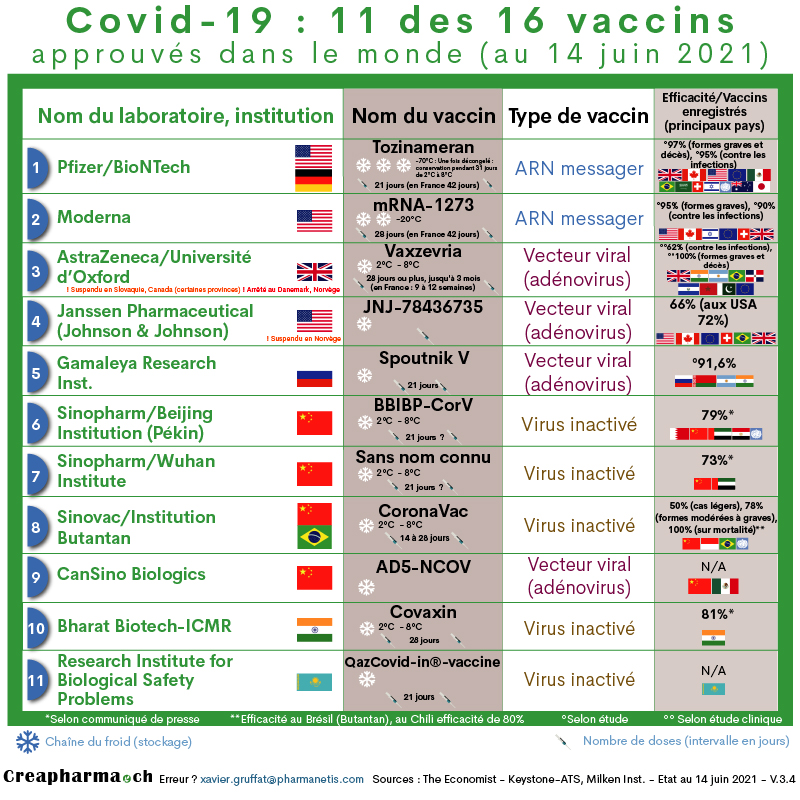
Le 29 octobre 2021, il y avait 22 vaccins (11 sont mentionnés ci-dessous) mis sur le marché et 104 en phase clinique (certains en phase 3), selon le site du Milken Institute.
Vaccins autorisés (commercialisés, mis sur le marché) :
– Pfizer/BioNTech – Nom du vaccin : Comirnaty® – Vaccin autorisé dans plusieurs pays (ex. Etats-Unis, Canada, Royaume-Uni, Union Européenne, etc.)
– Moderna (Lonza) – Nom du vaccin : Spikevax® – Vaccin autorisé dans plusieurs pays (Etats-Unis, Canada, Israël, Union Européenne, Suisse, etc.)
Lire aussi : dossier spécifique sur le vaccin Moderna
– Université d’Oxford/AstraZeneca – Nom du vaccin : AZD1222 – Vaccin autorisé dans plusieurs pays (Royaume-Uni, Argentine, Inde, Brésil). Lire aussi : dossier spécifique sur le vaccin AstraZenca/Oxford
Le vaccin a été arrêté totalement au Danemark, à cause de graves effets secondaires (rares) comme la thrombose pouvant mener à la mort.
– Gamaleya Research Inst. – Nom du vaccin : Spoutnik V – Vaccin autorisé dans plusieurs pays (Russie, Argentine, Biélarussie)
– Sinopharm/Beijing Institute – Nom du vaccin : BBIBP-CorV (vaccin avec le virus inactivé, voir la lettre C ci-dessous) – Vaccin autorisé dans plusieurs pays (Chine, Bahreïn, Émirats arabes unis, OMS)
– Sinopharm/Wuhan Institute – Sans nom connu du vaccin (vaccin avec le virus inactivé, voir la lettre C ci-dessous) – Vaccin autorisé dans plusieurs pays (Chine,…)
– Sinovac/Instituto Butantan – Nom du vaccin : CoronaVac (vaccin avec le virus inactivé, voir la lettre C ci-dessous) – Vaccin autorisé dans plusieurs pays (Chine, Brésil)
– CanSino Biologics – Nom du vaccin : AD5-NCOV (vecteur viral non réplicable à base d’adénovirus, voir la lettre E ci-dessous) – Vaccin autorisé en Chine (utilisation militaire)
– Un autre vaccin est enregistré en Inde, il s’appelle Covaxin est est développé par Bharat Biotech-ICMR1. – Vaccin autorisé en Inde
– Janssen Pharmaceutical (Johnson & Johnson ou J&J) – Nom du vaccin en Suisse : COVID-19 Vaccine Janssen, selon certains médias il porte le nom de Ad26.COV2.5 (vaccin avec un vecteur viral, une version affaiblie d’un virus du refroidissement ou cold en anglais, voir la lettre E ci-dessous), le vaccin de J&J est pris en dose unique, soit en une seule dose. Selon un communiqué de presse de l’entreprise J&J publié le 29 janvier 2021, l’efficacité serait en moyenne de 66%, avec des différences en fonction des régions où le vaccin a été administré (ex. 72% d’efficacité aux Etats-Unis, 66% en Amérique latine et 57% en Afrique du Sud2). – Vaccin autorisé aux Etats-Unis (mais suspendu depuis la mi-avril 2021), au Canada , dans l’UE, en Suisse (non administré à la mi-avril 2021).
Lire aussi : dossier spécifique sur le vaccin Johnson & Johnson
Vaccins en phase 3 (pas encore commercialisés) :
– Novavax – Nom du vaccin : NVX-COV2373 (vaccin de protéines, soit une sous-unité du vaccin ou péplomère recombinante). Selon un communiqué de presse de l’entreprise publié le 29 janvier 2021, le vaccin Novavax serait efficace à 89,3%.
Le site du Milken Institute, basé en Californie, résume les différentes phases cliniques des vaccins.
Remarque : la phase clinique 3 (ou III) est la dernière phase avant la commercialisation. Le vaccin est testé sur des dizaines de milliers de personnes (par ex. 15’000 personnes reçoivent deux doses du vaccin et 15’000 deux doses d’un vaccin placebo).
Différents vaccins et projets de vaccins (adénovirus, ARN, virus affaibli)
Il existe plusieurs types de candidats vaccin ou de vaccins contre la Covid-19 (en gras, projets les plus prometteurs) :
A. Vaccin à ARN
B. Vaccin à ADN
C. Vaccin avec le virus inactivé
D. Vaccin avec le virus affaibli
E. Vaccin avec un vecteur viral (à base d’adénovirus)
F. Vaccin de protéines
G. Vaccin avec des virus-like particules (VLP)
H. Autres
Remarque : le Milken Institute mentionne deux catégories différentes (Replicating viral vector et Non-Replicating viral vector) pour le vaccin avec un vecteur viral.
A. Vaccin à ARN (appelé aussi Morceaux d’ARN, en anglais : RNA-based)
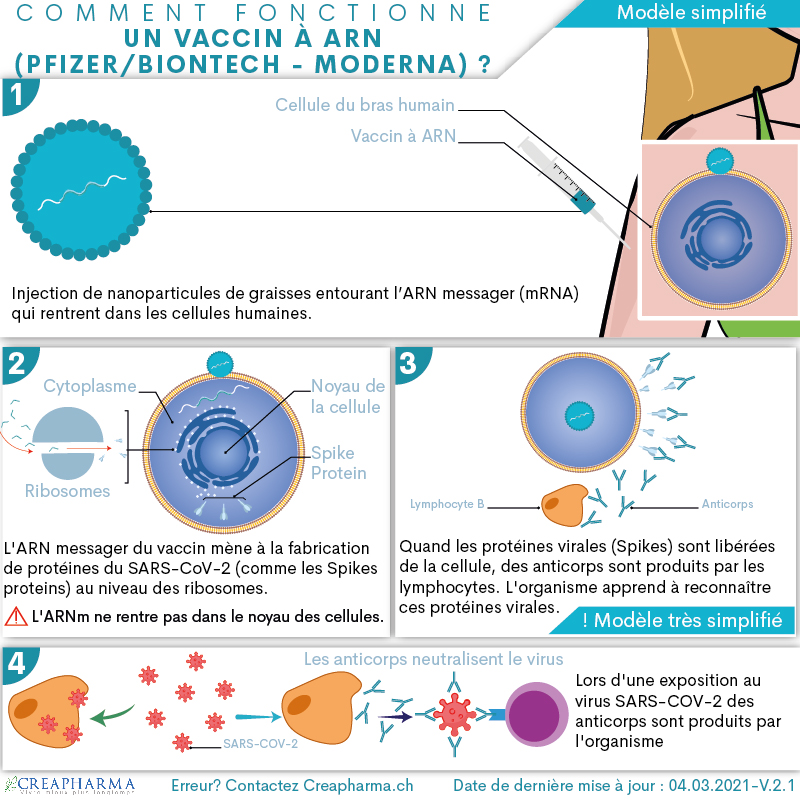
Un vaccin à ARN ou à ARN messager (mRNA en anglais) consiste à injecter des nanoparticules de graisses qui “entourent” l’ARN messager. Les molécules de graisse sont importantes pour protéger l’ARN qui est très fragile. En français on parle aussi d’un vaccin à morceaux d’ARN. Au contact des tissus humains, les molécules de graisse se séparent permettant à l’ARN d’entrer dans les cellules humaines (voir aussi infographie ci-dessous). Ces cellules vont commencer à fabriquer des protéines du SARS-CoV-2 (comme les Spikes proteins). La synthèse de ces protéines virales se fait dans les ribosomes, ces derniers traduisent l’ARN en protéines.
Le système immunitaire produit ensuite des anticorps dirigés contre le SARS-CoV-2, le virus à l’origine de la Covid-19.
– Il n’est pas possible à l’ARN de s’intégrer dans un génome humain (noyau cellulaire), constitué d’ADN. Pour que l’ARN s’intègre dans un ADN humain il doit être transcrit de façon inverse (rétrotranscription), ce processus n’est pas spontané au niveau cellulaire. Il faut savoir que l’ARN est une molécule très fragile, dégradé en 48h dans l’organisme humain.
Avantages :
– L’avantage des vaccins ARN (mRNA) est qu’ils sont considérés comme plutôt sûrs, c’est-à-dire avec peu d’effets secondaires, car ils ne contiennent pas de virus en entier.
– Les vaccins à ARN sont aussi plus rapides à développer qu’un vaccin à base de virus (lire ci-dessous).
– De plus, les vaccins ARN ont pour particularité de pouvoir être produits très facilement en très grande quantité, à la différence d’autres vaccins comme ceux avec un vaccin inactivé3.
Désavantages :
– Les désavantages sont une réponse immunologique plus faible et temporaire, ce qui demande deux doses ou plus, qu’avec d’autres types de vaccins (ex. virus inactivé).
– Un autre problème est qu’il faut souvent une chaîne du froid très avancée, car le vaccin se conserve dans certains cas à une température inférieure à -70°C. Cette chaîne du froid est peu réaliste dans des pays à faible revenu comme en Afrique. C’est le cas pour le vaccin de Pfizer, mais la préparation de Moderna devrait selon l’entreprise rester stable à des températures de réfrigération de 2 à 8 degrés Celsius pendant désormais 30 jours, contre une semaine estimée jusqu’ici. Le produit pourrait ainsi être acheminable via les infrastructures d’entreposage et de distribution de vaccins disponibles.
– Le prix par vaccin de Pfizer pourrait être de 25 à 30 dollars, soit un prix total pour 2 vaccins de 50 à 60 dollars. Dans beaucoup de pays, le vaccin est gratuit (payé par les impôts). Pour les pays à faible revenu ce vaccin est probablement trop cher4. Le vaccin d’Astra-Zeneca devrait coûter de 3 à 4 dollars par dose.
Des vaccins à ADN (lire ci-dessous sur les vaccins à ADN) existent à usage vétérinaire : chevaux, chiens, saumons, etc.
B. Vaccin à ADN (en anglais DNA-based)
Le vaccin à ADN (DNA en anglais) contient des plasmides, molécule de l’ADN de bactérie, modifiés en laboratoire. Dans la même logique que le vaccin à ARN, ces plasmides pénètrent ensuite les cellules humaines, qui vont commencer à fabriquer des protéines du SARS-CoV-2 (comme les Spikes proteins). Cela mène le système immunitaire à produire des anticorps dirigés contre le SARS-CoV-2, le virus à l’origine de la Covid-19.
L’avantage des vaccins à ADN est qu’ils sont considérés comme plutôt sûrs, c’est-à-dire avec peu d’effets secondaires, car ils ne contiennent pas de virus. La réaction immunologique du vaccin à ADN est plus forte que celle du vaccin à ARN. Le désavantage des vaccins à ADN est sa difficulté à les fabriquer.
C. Vaccin avec le virus inactivé ou mort (en anglais : Inactivated Virus)
Dans un premier temps, le virus est répliqué en laboratoire sur une surface biologique (organique) comme sur la coquille d’un œuf de poule. Les virus ou unités virales sont ensuite tués par exposition à la chaleur ou au formol. Le vaccin est ensuite purifié. Le matériel génétique du virus est détruit, d’où le terme de virus inactivé ou mort.
Les vaccins contre la polio, la grippe surtout, l’hépatite A ou la rage sont à base de virus inactivés. Un vaccin par virus inactivé présente peu d’effets secondaires, car il n’y a pas de réplication virale possible dans l’organisme. Le désavantage toutefois est une réponse immunologique plus faible que le virus affaibli, ce qui peut nécessiter un rappel (piqûre de rappel).
Réponse immunitaire :
La réponse immunitaire s’effectue principalement au niveau des anticorps et moins au niveau cellulaire (ex. lymphocytes).
Informations utiles :
Dans la Folha de S.Paulo, principal journal brésilien, du dimanche 20 décembre 2020 le scientifique Dimas Tadeu Covas de l’Université de Sao Paulo (USP) et président de l’institut Butantan a estimé que le vaccin le plus sûr testé en phase 3 au Brésil (presque tous les principaux vaccins ont été testés en phase 3 au Brésil) est le vaccin chinois Coronavac de Sinovac Biotech. Ce vaccin a été testé sur 12’500 volontaires, des professionnels de la santé âgés entre 18 et 59 ans, la moitié a reçu un placebo et l’autre moitié le vaccin. Jusqu’à présent selon M. Covas aucun effet secondaire grave n’a été constaté sur les participants. Il manque encore des données à analyser pour confirmer l’efficacité puis demander une mise sur le marché par exemple à l’ANVISA au Brésil ou au NMPA en Chine. Le 23 décembre 2020 ou avant les résultats finaux de l’efficacité devraient être présentés publiquement.
D. Vaccin avec le virus affaibli (en anglais : Live Attenuated Virus)
Le virus est affaibli en étant obligé d’infecter de nombreuses fois des cellules animales (ex. oeufs) en laboratoire jusqu’à ce que le virus ait acquis des mutations menant à une absence de dangerosité chez l’humain. Il existe sur le marché des vaccins à virus affaibli utilisés contre la rougeole, la rubéole ou la fièvre jaune. Un vaccin développé contre la polio reposait aussi sur un virus affaibli. Ce type de vaccin produit une réponse immunitaire très bonne. Mais comme le virus contient des extraits vivants, les effets secondaires peuvent être plus graves avec un risque possible, même limité, d’infections par la maladie. Ce risque est plus élevé chez les personnes immunodéprimées. Le célèbre scientifique français Louis Pasteur a découvert cette méthode de virus affaibli dans ses recherches sur des animaux infectés par le choléra aviaire.
E. Vaccin avec un vecteur viral, par exemple un adénovirus modifié (en anglais : Replicating viral vector ou Non-Replicating viral vector)
Remarque : le Milken Institute mentionne deux catégories différentes (Replicating viral vector et Non-Replicating viral vector) pour ce type de vaccin
Dans ce type de vaccin, un virus inoffensif (ex. adénovirus, à l’origine du rhume) est modifié en laboratoire au niveau d’un ou plusieurs gènes pour produire les protéines (ex. spike proteins) du SARS-CoV-2. Par exemple, si un adénovirus est utilisé il est affaibli pour ne pas provoquer de symptômes comme le rhume. Cette méthode existe depuis les années 1980.
Le vaccin à vecteur viral est considéré comme un vaccin sûr, sans risque d’effets secondaires graves. Le vaccin Ervebo contre Ebola (approuvé en 2019 par la FDA) du laboratoire Merck utilise cette technique de vecteur viral.
Réponse immunitaire :
L’avantage du vaccin à vecteur viral (par exemple à la différence du vaccin à virus atténué, voir point C ci-dessus) est qu’en plus de favoriser une production d’anticorps, le vaccin active aussi une réponse cellulaire avec les lymphocytes (lire étude ci-dessous).
F. Vaccin de protéines (en anglais : Protein subunit)
Ce vaccin est créé à base des protéines de pointes (Spike proteins) du SARS-CoV-2. On estime que ce vaccin pourrait être plus efficace que les vaccins à base d’ARN et d’ADN (lire ci-dessus), comme cela évite la réponse immunologique de création des protéines de pointes. Un vaccin contre la polio, développé notamment par l’Université de Pittsburgh, repose sur cette technique. Dans cette technique, seulement des parts (des protéines) du virus sont présentées à l’être humain.
Réponse immunitaire :
L’immunité pourrait toutefois être de courte durée nécessitant ainsi plusieurs vaccinations. L’addition de molécules adjuvantes à ce vaccin permet de renforcer ou booster l’immunité.
G. Vaccin avec des virus-like particule ou VLP (en anglais : Virus-Like Particule)
Dans un vaccin avec des virus-like particules (VLP), le virus n’a plus de matériel génétique, dans le cas du SARS-CoV-2 il n’y a plus d’ARN. Ce type de vaccin n’a pas la capacité d’infecter une personne, comme il n’y a pas de matériel génétique. Ces virus sont créés en laboratoire et la réplication a lieu dans des cellules animales ou végétales (ex. dans des plants de tabac). Des vaccins contre l’hépatite B, la malaria (paludisme) et le HPV sont à base de cette technique. Ce type de vaccin serait plus efficace que le vaccin à ARN (voir point 1. ci-dessus). Un aspect négatif est que ce vaccin doit toujours être refroidi (chaîne du froid).
H. Autres vaccins (en anglais : Other Vaccines)
Dans cette catégorie on trouve les vaccins qui n’appartiennent pas aux 7 (ou 8 selon la classification proposée par le Milken Institute). Comme le précise le Milken Institute, d’un vaccin à anticorps codés par un gène à un vaccin auto-assemblé et plus encore, ce sont les vaccins en cours de développement qui n’entrent pas facilement dans l’une des autres catégories de produits ou les détails sur sa catégorie ne sont pas accessibles au public.
Nombre de doses du vaccin
Beaucoup de vaccins nécessitent la prise de 2 doses, mais pour ceux qui ont déjà eu la Covid-19 une dose est suffisante, en tout cas selon la Haute autorité de santé (HAS) française qui a recommandé le 12 février 2021 de recevoir une seule dose pour les personnes ayant déjà eu la Covid-19. La France est le premier pays à émettre une telle recommandation, selon Le Figaro. L’avis de la HAS doit encore recevoir l’aval du gouvernement. Selon la HAS, la dose unique de vaccin joue un rôle de rappel (booster en anglais) pour les personnes déjà infectées par le passé. La HAS recommande par ailleurs d’attendre au-delà de trois mois après la maladie (premiers symptômes) et de préférence six mois avant d’injecter cette dose unique.
De plus, une étude publiée le 9 février 2021 en preprint (pas encore validée par les pairs) dans la revue scientifique medRxiv (DOI : 10.1101/2021.02.07.21251311) a montré que les réponses immunitaires à la 2ème dose du vaccin à ARNm de Pfizer et BioNTech appelé BNT162b2 sont faibles chez les sujets ayant déjà été infectés par le SARS-CoV-2 (à l’origine de la Covid-19). Autrement dit, les personnes ayant déjà été exposées au SARS-CoV-2 par le passé ont présenté de fortes réponses humorales et des réponses des cellule sécrétant des anticorps (en anglais ASC) spécifiques à l’antigène à la première dose, mais des réponses atténuées à la deuxième dose du vaccin pour les points de temps étudiés.
Lire aussi : dossier complet contre la Covid-19 – dossier spécifique sur le vaccin Pfizer et BioNTech
Sources & Références :
Sources :
Milken Institute, Handelsblatt (plusieurs éditions), magazine Superinteressante (juillet 2020), Folha de S.Paulo, UOL.com.br (citant Reuters notamment), The Wall Street Journal, Le Monde (online), Keystone-ATS (agence de presse suisse), Keystone-ATS (le partenaire de Creapharma.ch, Pharmapro.ch, est client de cette agence de presse suisse), New York Times, Le Temps.ch, CNN.com, The Economist, Le Figaro.
Références :
The Lancet (DOI : 10.1016/S0140-6736(20)31611-1)
Personnes responsables et impliquées dans l’écriture de ce dossier :
Xavier Gruffat (Pharmacien et Rédacteur en chef de Creapharma), Seheno Harinjato (Rédactrice chez Creapharma.ch, responsable des infographies)
Crédits photos :
Adobe Stock, © 2021 Pixabay, Creapharma.ch
Infographies :
Pharmanetis Sàrl (Creapharma.ch), Pharmapro Sàrl.
Date de la dernière mise à jour du dossier :
07.11.2021 (par XG)
Références scientifiques et bibliographie :
- The Economist, édition du 9 janvier 2021
- The Wall Steet Journal, 29.01.2021
- News du Figaro et AFP, en date du 9 novembre 2020, accédé à la même date
- Le Monde, journal du 11 novembre 2020


